Предикторные возможности параметров миокардиальной работы левого желудочка у пациентов с первым инфарктом миокарда и чрескожным коронарным вмешательством
Т.М. Тимофеева1,2, А.Ф. Сафарова1,2, Ж.Д. Кобалава2, В.П. Ефимова1, Т.В. Лобжанидзе2, Е.М. Озова1,2
1ГБУЗ «Городская клиническая больница имени В.В. Виноградова Департамента здравоохранения Москвы», Москва
2Кафедра внутренних болезней с курсом кардиологии и функциональной диагностики имени академика В.С. Моисеева медицинского института ФГАОУ ВО «Российский университет дружбы народов», Москва
РЕЗЮМЕ
Введение. Оценка миокардиальной работы (МР) демонстрирует неоспоримые преимущества по сравнению с фракцией выброса левого желудочка (ФВ ЛЖ) для оценки прогноза после инфаркта миокарда (ИМ), поскольку учитывает уровень постнагрузки. Роль миокардиальных индексов в прогнозировании исходов у пациентов после первого острого ИМ изучена недостаточно.
Цель исследования. Оценка параметров глобальной продольной сократимости (GLS) ЛЖ и МР и их прогностической способности у пациентов с первым ИМ и успешным чрескожным коронарным вмешательством (ЧКВ).
Методы. В проспективное одноцентровое исследование включен 131 пациент с первым острым ИМ без анамнеза сердечной недостаточности (СН) и успешным ЧКВ. ФВ ЛЖ оценивалась перед ЧКВ и повторно перед выпиской из стационара с параметрами МР и GLS. Конечная точка: госпитализация c СН. Медиана периода наблюдения: 1,5 года.
Результаты. ИМ с подъемом сегмента ST диагностирован у 26,0% пациентов; ФВ ЛЖ менее 50% при выписке регистрировалась у 64 (48,9%) пациентов. Средний перипроцедурный прирост ФВ ЛЖ составил 4,0% в общей группе. Госпитализация с СН за период наблюдения зарегистрирована у 34 (26,0%) пациентов. Предиктором ее явились значения глобальной напрасной работы (GWW) > 161,5 mmHg% и значение GLS > 13,7% (р = 0,026, AUC = 0,638 и р = 0,024, AUC = 0,628 соответственно). GWW < 161,5 mmHg% уменьшает риски госпитализации с СН в 2,65 раза (ОР = 0,377; 95% ДИ: 0,158–0,900; p = 0,028). Бессобытийная выживаемость у пациентов со значениями GWW больше и меньше порогового уровня максимально различается через 2 года и более после ОИМ. При уровне GLS > 13,7% перед выпиской риск госпитализации с СН в течение 1,5 года снижается в 2,34 раза (ОШ = 0,428; 95% ДИ: 0,182–0,960). Значимыми предикторами госпитализации с СН являются GLS (ОШ = 0,75; 95% ДИ: 0,61–0,92; р = 0,006), GCW (ОШ = 0,85; 95% ДИ: 0,74–0,99; р = 0,036) и ΔФВ ЛЖ (ОШ = 0,88; 95% ДИ: 0,78–0,99; р = 0,040), вошедшие в разработанную прогностическую модель.
Заключение. У пациентов с первым острым ИМ, независимо от ФВ ЛЖ при поступлении, при отсутствии клинических признаков СН для расчета риска госпитализации с СН в течение 550 дней может использоваться разработанная прогностическая модель, включающая показатели GLS, GCW и ΔФВ ЛЖ, а также учитываться уровень GWW.
КЛЮЧЕВЫЕ СЛОВА: инфаркт миокарда, спекл-трекинг эхокардиография, миокардиальная работа.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы заявляют об отсутствии конфликта интересов.
Predictive possibilities of parameters of myocardial work of left ventricle in patients with first myocardial infarction and percutaneous coronary intervention
T.M. Timofeeva1,2, A.F. Safarova1,2, Zh.D. Kobalava2, V.P. Efimova1, T.V. Lobzhanidze2, E.M. Ozova1,2
1City Clinical Hospital n.a. V.V. Vinogradov, Moscow, Russia
2Peoples’ Friendship University of Russia, Moscow, Russia
SUMMARY
Introduction. The assessment of myocardial performance (MR) demonstrates undeniable advantages over the left ventricular ejection fraction (LVEF) for assessing the prognosis after myocardial infarction (MI), since it takes into account the level of afterload. The role of myocardial indices in predicting outcomes in patients after the first acute MI is not well understood.
Purpose of the study. Evaluation of LV and MR global longitudinal contractility (GLS) parameters and their predictive ability in patients with first MI and successful percutaneous coronary intervention (PCI).
Methods. A prospective single-center study included 131 patients with a first acute MI without a history of heart failure (HF) and successful PCI. LV EF was assessed before PCI and again before discharge from the hospital with MR and GLS parameters. Endpoint: hospitalization with HF. Median follow-up: 1.5 years.
Results. ST elevation MI was diagnosed in 26.0% of patients; LV EF less than 50% at discharge was recorded in 64 patients (48.9%). The average periprocedural increase in LV EF was 4% in the general group. Hospitalization with HF during the observation period was registered in 34 (26.0%) patients. It was predicted by global waste work (GWW) > 161.5 mmHg% and GLS > 13.7% (p = 0.026, AUC = 0.638 and p = 0.024, AUC = 0.628 respectively). GWW < 161.5 mmHg% reduces the risk of hospitalization with heart failure by 2.65 times (HR = 0.377 with 95% CI: 0.158–0.900; p = 0.028). Event-free survival in patients with GWW values above and below the threshold level differs to the maximum 2 or more years after AMI. At GLS > 13.7% before discharge, the risk of hospitalization with heart failure within 1.5 years is reduced by 2.34 times (OR = 0.428; 95% CI: 0.182–0.960). Significant predictors of hospitalization with heart failure are GLS (OR = 0.75; 95% CI: 0.61–0.92; p = 0.006), GCW (OR = 0.85; 95% CI: 0.74–0.99; p = 0.036) and LVEF (OR = 0.88; 95% CI: 0.78–0.99; p = 0.040) included in the developed prognostic model.
Conclusion. In patients with first acute MI, regardless of LV EF, at admission in the absence of clinical signs of HF, a developed prognostic model can be used to calculate the risk of hospitalization with HF within 550 days, including GLS, GCW and LV ΔEF, and the GWW level can also be taken into account.
KEYWORDS: myocardial infarction, speckle tracking echocardiography, myocardial work.
CONFLICT OF INTEREST. The authors declare no conflict of interest.
Введение
Эхокардиографическое исследование рекомендуется как с диагностической целью, так и для определения прогноза пациентов, перенесших инфаркт миокарда (ИМ) [1]. Учитывая высокий уровень заболеваемости, инвалидизации и смертности [1, 2], актуальна разработка новых показателей у пациентов с острым инфарктом миокарда (ОИМ), подверженных повышенному риску развития сердечно-сосудистых осложнений, включая сердечную недостаточность (СН) [3, 4]. В клинической практике оценка фракции выброса левого желудочка (ФВ ЛЖ), как основного показателя систолической дисфункции ЛЖ, остается признанным прогностическим маркером [1, 3, 5, 6]. Однако есть ряд ограничений, таких как влияние пред- и постнагрузки, что снижает адекватность оценки функционального состояния миокарда [6]. Двухмерная спекл-трекинг-эхокардиография (Эхо-КГ) с оценкой миокардиальной работы демонстрирует неоспоримые преимущества изучаемых параметров по сравнению с ФВ ЛЖ для прогноза после ИМ [7, 8], поскольку учитывает уровень постнагрузки путем интегрирования измерений систолического артериального давления (САД) для построения кривой «давление – деформация» [9, 10].
Для оценки индивидуального прогноза у пациентов в постинфарктном периоде большое значение придается также динамике ФВ ЛЖ. Так, по данным исследований, после ИМ с подъемом сегмента ST (ИМпST) 25% пациентов имеют ФВ ЛЖ < 40% и только у 40% из них она увеличится до 50% и более через 6 месяцев наблюдения [11–13]. Пациенты, у которых не происходит увеличения или нормализации ФВ ЛЖ после ИМ, имеют более высокую частоту остановки сердца и уровень смертности [12, 13].
Однако связь между показателями глобальной деформации и миокардиальной работы, перипроцедурной динамикой ФВ ЛЖ и влияние их на прогноз у пациентов с первым ИМ и чрескожным коронарным вмешательством (ЧКВ) изучена недостаточно. Таким образом, целью нашего исследования явилось изучение связи между показателями миокардиальной работы, перипроцедурной динамикой ФВ ЛЖ и их влияние на долгосрочный прогноз у данной категории пациентов.
Материалы и методы
В проспективное одноцентровое наблюдательное исследование включен 131 пациент, госпитализированный в ОРИТ ГБУЗ «ГКБ имени В.В. Виноградова» с острым коронарным синдромом с и без подъема сегмента ST. Средний возраст составил 61,7 ± 11,5 года; доля мужчин 68%; ИМбпST диагностирован у 74% пациентов; медиана ФВ ЛЖ при поступлении составила 47% (44; 50).
Критерии включения: первый ОИМ, диагностированный в соответствии с четвертым универсальным определением ИМ [1]; успешное первичное ЧКВ у пациентов с ИМпST, ранним (в течение 24 часов) ЧКВ у пациентов с ИМ без подъема сегмента ST (ИМбпST), то есть достижение кровотока TIMI III в пораженном сосуде; сумма В-линий менее 5 при ультразвуковом исследовании (УЗИ) легких; отсутствие анамнеза СН, одышки при поступлении, Killip 1.
Критерии невключения: применение диуретиков и вазопрессоров, первичная патология легких (пневмонии), онкологические заболевания легких, развитие осложнений ОИМ (разрыв межжелудочковой перегородки, отрыв папиллярной мышцы), тяжелые нарушения ритма и проводимости сердца на момент включения, в том числе фибрилляция и трепетание предсердий.
Исследование соответствует этическим стандартам, разработанным в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» и «Правилами клинической практики в Российской Федерации». Все лица, участвующие в исследовании, дали информированное согласие на участие в исследовании. Исследование одобрено комитетом по этике медицинского института РУДН.
У всех пациентов, включенных в исследование, при поступлении проводили сбор анамнеза, стандартное физическое обследование, Эхо-КГ, рентгенологическое исследование органов грудной полости, эхокардиографию, УЗИ легких, коронароангиографию и ангиопластику со стентированием коронарных артерий. Лабораторные исследования выполняли в соответствии с российскими стандартами оказания медицинской помощи: общий и биохимический анализ крови, в том числе определяли уровень тропонина I при поступлении и через 6–12 часов после госпитализации, дополнительно определяли мозговой натрийуретический гормон (NT-proBNP).
Комплексная трансторакальная Эхо-КГ выполнялась при поступлении в ОРИТ до ЧКВ и при выписке с последующей постобработкой на станции Echopac (General Electric Healthcare, США) с автоматической оценкой ФВ ЛЖ по методу Симпсона. Диастолическую функцию ЛЖ оценивали по следующим параметрам: E, E/A, е’lat, Е/е’lat, индексированный объем левого предсердия (ИОЛП) и максимальная скорость трикуспидальной регургитации [14]. Для расчета значения глобальной продольной сократимости (GLS) и миокардиальной работы использовалась рабочая станция EchoPAC (версия 201). Эндокард ЛЖ отслеживался точечно в каждой из указанных позиций по 17 сегментам ЛЖ, по результатам автоматически рассчитывалось значение GLS (максимальное сокращение продольной длины миокарда во время систолы по сравнению с длиной покоя в диастоле, выражающееся в процентах).
При выписке параметры миокардиальной работы неинвазивно оценивали на основе расчетного систолического давления в ЛЖ, за которое принималось систолическое АД, измеренное с помощью плечевой манжеты, и измерения деформации [10]. Оценивались следующие параметры миокардиальной работы: глобальный рабочий индекс (GWI), глобальная конструктивная работа (GCW), глобальная напрасная работа (GWW), общая эффективность работы (GWE) [15].
Глобальный рабочий индекс – общая работа, выполняемая ЛЖ во время механической систолы (при закрытом митральном клапане), включая изоволюметрическое сокращение и расслабление. Этот период отражен площадью внутри петли «давление – деформация». Учитывая, что работа определяется как сила, умноженная на длину, использование давления и деформации не позволяет напрямую измерить работу, а вместо этого выводится индекс.
Глобальная конструктивная работа – продуктивная работа ЛЖ во время систолы, включающая укорочение мышцы во время систолы и удлинение мышцы в фазу изоволюметрического расслабления.
Глобальная напрасная работа – работа, выполняемая ЛЖ во время систолы, которая не является продуктивной, включает удлинение мышцы во время систолы и укорочение мышцы в фазу изоволюметрического расслабления. Бесполезная работа увеличивает метаболическую нагрузку на желудочек, что может способствовать неблагоприятному ремоделированию.
Общая эффективность работы – отношение конструктивной работы к сумме конструктивной и напрасной работы (GCW / GCW + GWW) (рис. 1).
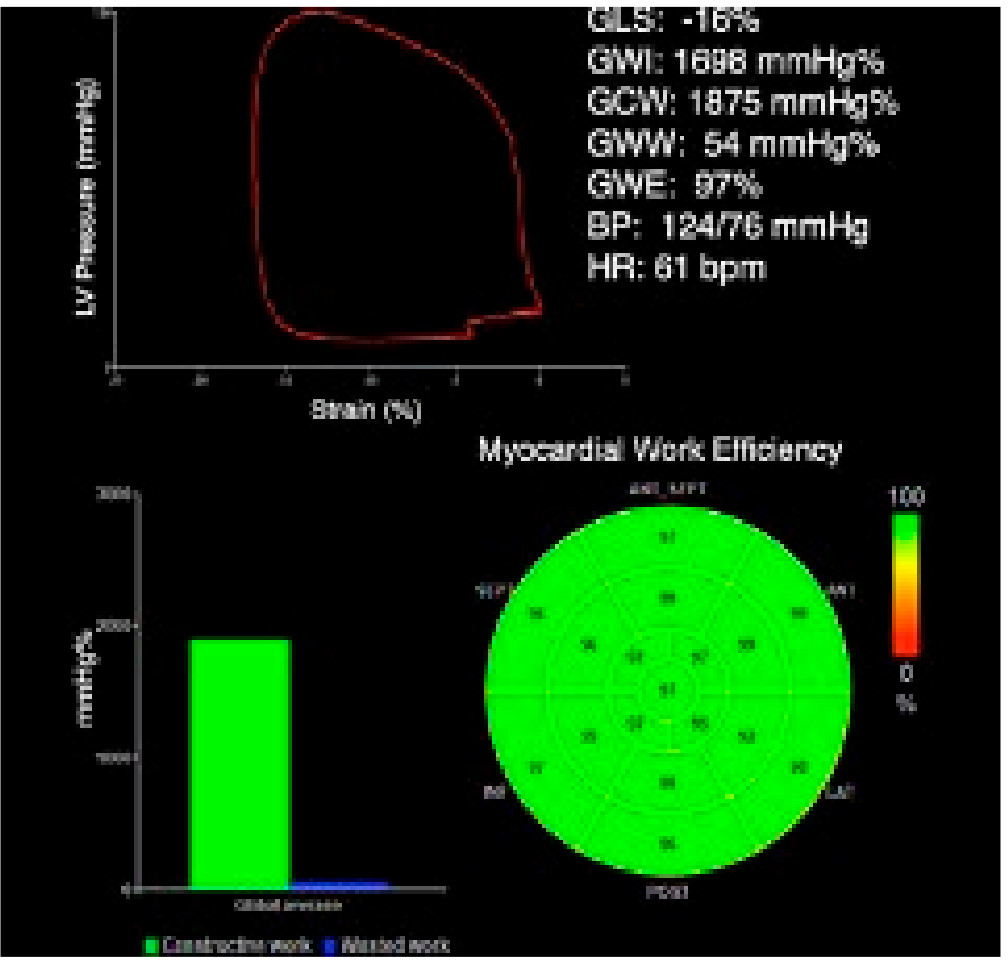
Рисунок 1. Расчет параметров миокардиальной работы с помощью специального программного обеспечения.
Все пациенты были дополнительно стратифицированы на основе перипроцедурной динамики ФВ ЛЖ. Критерием перипроцедурного улучшения ФВ ЛЖ было принято увеличение ее на 5% при выписке, у пациентов с исходной ФВ ЛЖ менее 50% дополнительным критерием перипроцедурной динамики было увеличение ее до 50% и выше [12].
Все пациенты в госпитальном периоде и в течение года после выписки находились на стандартной двойной антиагрегантной терапии, статистически значимой разницы в частоте назначения болезнь-модифицирующих препаратов между группами пациентов не было.
Исходы
Основными оцениваемыми исходами были: госпитализация по поводу СН; сердечно-сосудистая смерть (ССС), а также комбинированная точка (госпитализация по поводу СН + ССС). Данные были получены в единой медицинской информационно-аналитической системе, а также по данным телефонных контактов; медиана периода наблюдения составила 1,5 года.
Статистический анализ
Анализ данных проводился с использованием программного обеспечения SPSS (версия 26.0) и MedCalc (версия 19). Количественные переменные описывали как среднее арифметическое значение (М) и стандартное отклонение среднего значения (SD) (при нормальном распределении) или для количественных переменных с асимметричным распределением рассчитывались медиана (Me) и интерквантильный размах (IQR). Качественные переменные описывали абсолютными (n) и относительными (%) значениями. Проверка распределений выполнялась с использованием критерия Колмогорова – Смирнова. Непараметрический метод Спирмена использовали для измерения ранговой корреляции (статистическая зависимость между ранжированием двух переменных). Для оценки различий между двумя независимыми выборками по уровню количественного признака использовали U-критерий Манна – Уитни. Для сравнения частот признаков и качественных переменных пользовались критерием хи-квадрат Пирсона (χ2) или точным критерием Фишера. Результаты считали статистически значимыми при значениях двустороннего р < 0,05. Влияние изучаемых показателей на риск развития конечных точек оценивали при одно- и многофакторном анализе Кокса. При помощи логистической регрессии определялись предикторы наступления конечных точек. Пороговые значения для количественных предикторов устанавливались при оптимальном соотношении чувствительности и специфичности по данным ROC-анализа. Вероятность выживания оценивали методом построения кривых выживаемости Каплана – Майера, сравнение производили с помощью лог-рангового критерия.
Результаты исследования
В общей группе пациентов (табл. 1) в течение периода наблюдения было зарегистрировано 34 случая госпитализации с СН (26,0%), 10 смертей от сердечно-сосудистых заболеваний (7,6%), 44 комбинированные точки (33,6%).
Таблица 1
Клинико-демографическая характеристика пациентов с ОИМ, включенных в исследование (n = 131)
| Параметры | Значение |
| Возраст, лет M ± SD | 61,7 ± 11,45 |
| Мужчины, n (%) | 89 (67,9) |
| Индекс массы тела, кг/м2 (Me [IQR]) | 27,6 (25,45; 31,5) |
| Курение, n (%) | 53 (40,5) |
| Злоупотребление алкоголем, n (%) | 5 (3,8) |
| САД при поступлении, мм рт. ст. (Me [IQR]) | 135 (126,5; 151,0) |
| ДАД при поступлении, мм рт. ст., (Me [IQR]) | 80 (70; 87) |
| ЧСС при поступлении, уд./мин, (Me [IQR]) | 68 (64; 72) |
| Сопутствующие заболевания | |
| Фибрилляция предсердий в анамнезе, n (%) | 13 (9,56) |
| Гипертоническая болезнь, n (%) | 93 (71,0) |
| Сахарный диабет 2 типа, n (%) | 27 (20,6) |
| Инсульт в анамнезе, n (%) | 5 (3,8) |
| Дислипидемия, n (%) | 63 (48,1) |
| Характеристика инфаркта миокарда | |
| ИMбпST/ ИМпST, n (%) | 97 (74,0) / 34 (26,0) |
| ИМ передней стенки, n (%) | 70 (53,4) |
| ИМ нижней стенки, n (%) | 61 (46,6) |
| Однососудистое поражение, n (%) | 44 (33,6) |
| Многососудистое поражение, n (%) | 87 (66,4) |
| Шкала TIMI (Me [IQR]) | 3 (3; 4) |
| Шкала CRUSADE, (Me [IQR]) | 28 (21; 37) |
| Шкала GRACE, (Me [IQR]) | 131,0 (118,0; 153,0) |
| Шкала SYNTAX, (Me [IQR]) | 22 (15; 31) |
| Лабораторные показатели | |
| Креатинин, мкмоль/л, (Me [IQR]) | 86,0 (76,5; 100,7) |
| CКФ CKD-EPI, мл/мин/1,73 м3 (Me [IQR]) | 73,40 (63,00; 87,82) |
| Глюкоза, ммоль/л, (Me [IQR]) | 7,1 (5,9; 8,9) |
| О-ХС, ммоль/л (M ± SD) | 5,8 ± 1,7 |
| Гемоглобин, г/л (M ± SD) | 142,2 ± 16,5 |
| NT-proBNP, пг/мл (Me [IQR]) | 602,0 (263,7; 1445,8) |
| Тропонин 1, нг/мл (Me [IQR]) | 0,23 (0,05; 1,75) |
| Тропонин 2, нг/мл (Me [IQR]) | 11,5 (1,2; 46,2) |
Для выявления предикторов развития неблагоприятных исходов среди параметров миокардиальной работы исследуемые были разделены на группы с и без зарегистрированных исходов.
При сравнении анамнестических данных, клинических характеристик пациентов в группах с и без осложнений за период наблюдения, кроме различий по перипроцедурной динамике и частоте гипертонической болезни в анамнезе, были выявлены статистически значимые различия и в показателях GLS и миокардиальной работы (табл. 2).
Таблица 2
Показатели GLS и миокардиальной работы у пациентов после ОИМ с отдаленными исходами
| Параметр Исход | Смерть от сердечно-сосудистого заболевания (n = 10) | р | Госпитализация по поводу СН (n = 34) | р | Комбинированная точка (n = 44) | р | |||
| Да | Нет | Да | Нет | Да | Нет | ||||
| GLS, % (Me [IQR]) | –13,0 (–14,3; –11,7) | –14,0 (–17,0; –11,6) | 0,413 | –12,8 (–14,0; –9,5) | –15,0 (–17,0; –12,0) | 0,024* | –12,6 (–14,0; –10,7) | –15,0 (–17,0; –12,0) | 0,068 |
| GWE, % (Me [IQR]) | 83 (69; 83) | 88 (85; 92) | 0,070 | 87 (84; 89) | 89 (85; 93) | 0,050* | 86 (82; 88) | 90 (85; 93) | 0,012* |
| GWW, мм рт. ст. % (Me [IQR]) | 230 (162; 268) | 152 (93; 204) | 0,048* | 189 (147; 227) | 144 (91; 200) | 0,026* | 193 (148; 233) | 140 (91; 196) | 0,004* |
Примечание: * – различия показателей статистически значимы (p < 0,05).
По показателям глобальной конструктивной работы, индекса глобальной работы пациенты с и без отдаленных исходов статистически значимых различий не имели так же, как и по абсолютным значениям ФВ ЛЖ при поступлении и после ЧКВ.
Для выявления предикторов госпитализации с СН среди показателей миокардиальной работы был выполнен одно- и многофакторный анализ. При однофакторном анализе выявлено статистически значимое влияние уровня GWW на развитие исхода (рис. 2).
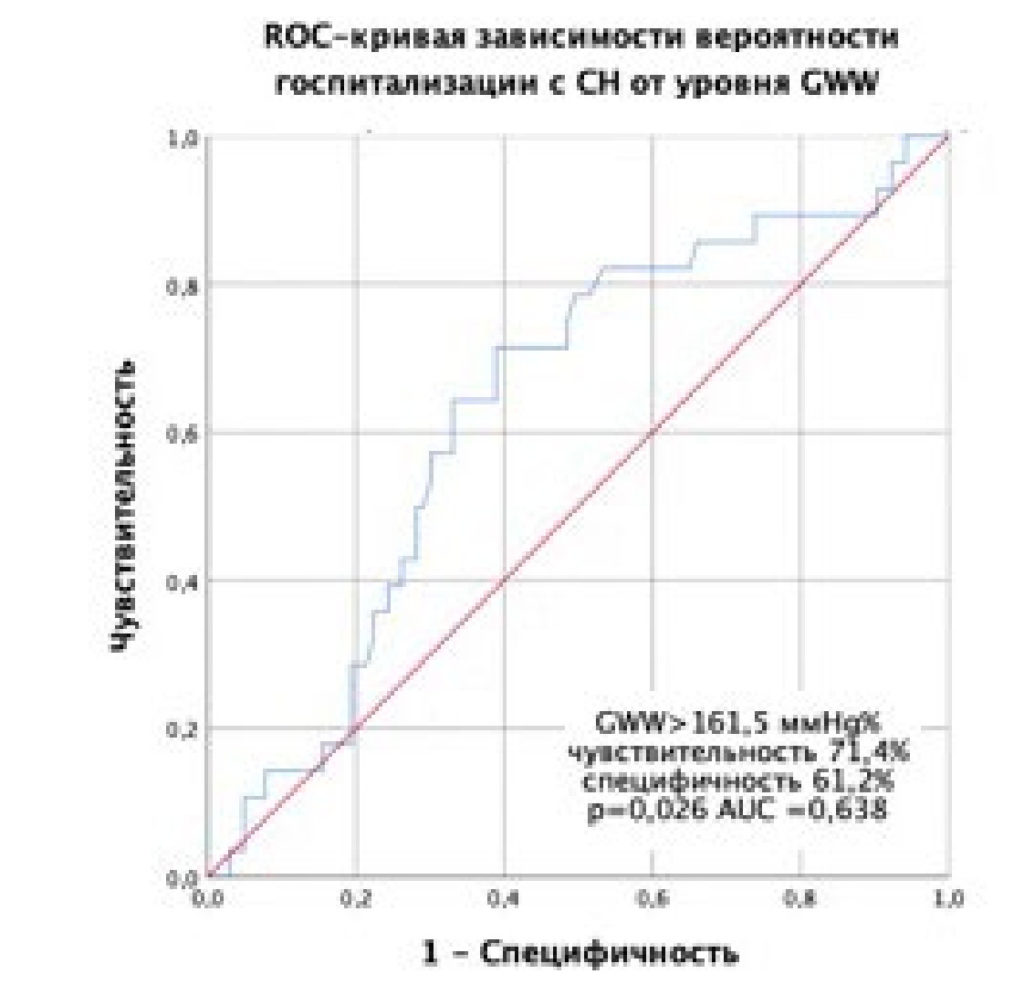
Рисунок 2. ROC-кривая, характеризующая зависимость вероятности госпитализации с СН от значений GWW.
С наилучшим показателем специфичности и чувствительности по данным анализа выбрано значение GWW > 161,5 mmHg%. При сравнении клинических характеристик пациентов со значениями GWW более и менее выбранного порогового балла выявлено, что повышенный ИМТ, более низкие показатели GLS и GWE имели пациенты с GWW > 161,5 mmHg%. Пациенты с повышенной GWW имели меньшие значения Е, Е/а, MAPSE, по данным эхокардиографии, по сравнению с пациентами с более низкой напрасной миокардиальной работой (табл. 3).
Таблица 3
Сравнительная характеристика пациентов с напрасной миокардиальной работой более и менее порогового значения 161,5 mmHg%
| Показатель | GWW < 161,5 mmHg% | GWW > 161,5 mmHg% | р |
| Индекс массы тела, кг/м2 | 27,0 (25,3; 30,2) | 28,9 (26,0; 33,0) | 0,021* |
| GLS, % | –16,0 (–17,0; –12,0) | –13,0 (–14,0; –11,0) | 0,001* |
| GLS > –13,7%, n (%) | 22 (38,6) | 35 (61,4) | 0,001* |
| GWE, % | 91,5 (88,6; 94,0) | 86,0 (82,0; 87,0) | < 0,001* |
| E/a | 0,84 (0,63; 1,10) | 0,70 (0,56; 0,80) | < 0,001* |
| Е, см/с | 0,58 (0,45; 0,70) | 0,44 (0,40; 0,55) | < 0,001* |
| MAPSE, см | 1,5 (1,30–1,60) | 1,3 (1,20; 1,60) | 0,015* |
Примечание: * – различия показателей статистически значимы (p < 0,05).
При оценке влияния показателя напрасной миокардиальной работы > 161,5 mmHg% на выживаемость без госпитализации с СН в постинфарктном периоде с помощью лог-рангового критерия Мантеля – Кокса отмечалось статистически значимое повышение выживаемости при уровне GWW < 161,5 mmHg% (p = 0,024). При оценке отношения рисков госпитализации с СН у пациентов с GWW < 161,5 mmHg%, по сравнению с пациентами c GWW > 161,5 mmHg%, было получено значение ОР = 0,377 с 95% ДИ: 0,158–0,900 (p = 0,028). То есть наличие GWW > 161,5 mmHg% увеличивает риски госпитализации по поводу развития СН в 2,65 раза.
Значения выживаемости пациентов без госпитализации по поводу СН, в зависимости от уровня GWW, были также сопоставлены с помощью кривых Каплана – Мейера (рис. 3).
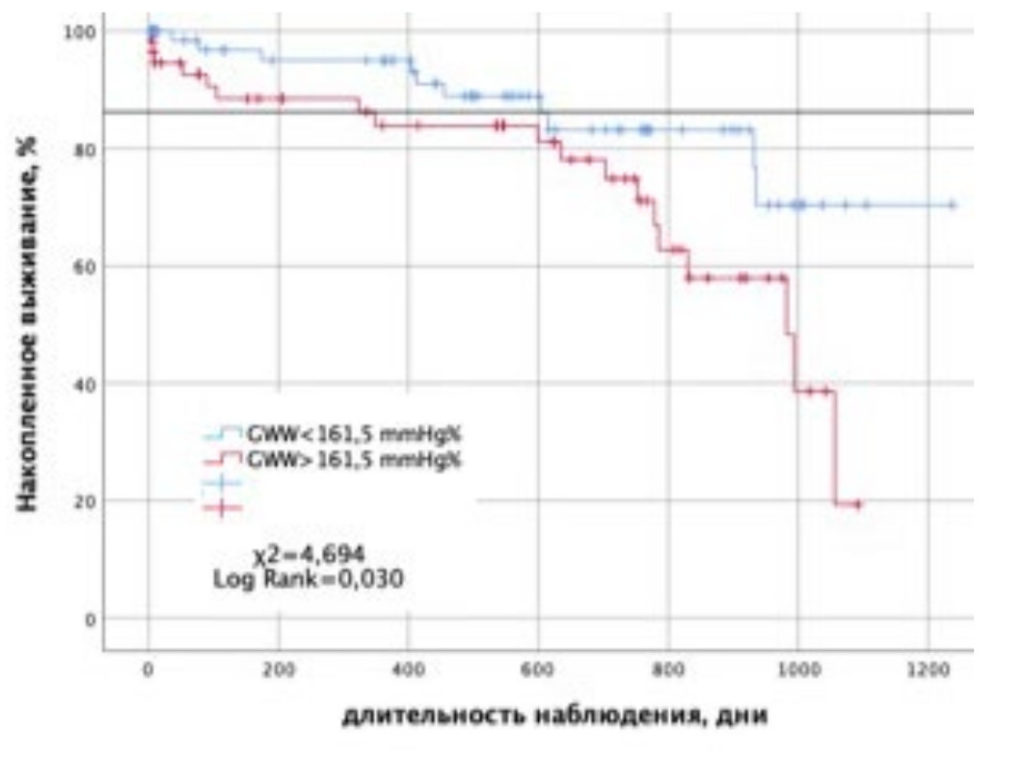
Рисунок 3. Кривые Каплана – Майера кумулятивной вероятности выживания без госпитализации с СН в зависимости от уровня GWW.
Значимым предиктором госпитализации с СН также явилось значение GLS < –13,7% (рис. 4).
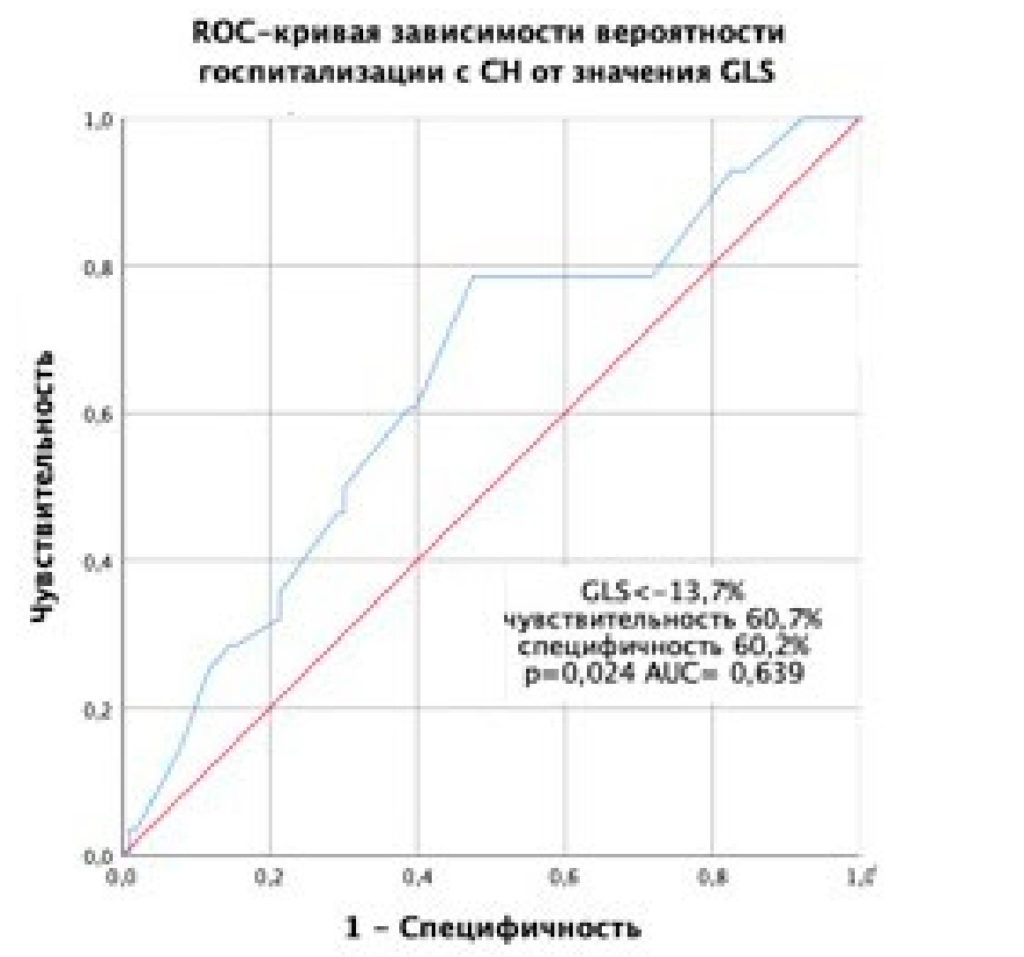
Рисунок 4. ROC-кривая, характеризующая зависимость вероятности госпитализации с СН от значений GLS.
При уровне GLS < –13,7% % перед выпиской у пациента после ОИМ и ЧКВ риск госпитализации с СН в течение 1,5 года снижается в 2,34 раза (ОШ = 0,428; 95% ДИ: 0,182–0,960).
Корреляционные связи между показателями миокардиальной работы, клиническими и другими эхокардиографическими характеристиками представлены в таблице 4.
Таблица 4
Корреляции между показателями миокардиальной работы
| Параметр | Параметр | R | p* |
| GLS, % | Количество дней госпитализации | 0,307 | 0,038 |
| СД в анамнезе | 0,360 | 0,014 | |
| Передний ИМ | 0,427 | 0,003 | |
| ФВ ЛЖ при поступлении | –0,578 | < 0,001 | |
| ФВ ЛЖ при выписке | –0,745 | < 0,001 | |
| MAPSE | –0,449 | 0,002 | |
| ИММЛЖ | 0,533 | < 0,001 | |
| ОТС | 0,504 | < 0,001 | |
| Е/е’ | –0,450 | 0,002 | |
| Назначение диуретиков в постинфарктном периоде | 0,477 | 0,001 | |
| Тяжелый субклинический легочный застой | 0,467 | 0,016 | |
| NT-pro-BNP | 0,416 | 0,020 | |
| Госпитализация с СН | 0,205 | 0,019 | |
| GWI, % | Передний ИМ | –0,341 | > 0,001 |
| MAPSE | 0,233 | 0,007 | |
| ИММЛЖ | –0,268 | 0,002 | |
| СДЛА | –0,266 | 0,002 | |
| Умеренная митральная регургитация | –0,183 | 0,037 | |
| Тропонин 2 | –0,372 | > 0,001 | |
| Длительность бессобытийного (без СН) периода | 0,356 | 0,039 | |
| GWW | Женский пол | 0,410 | 0,005 |
| Возраст | 0,488 | 0,001 | |
| БЛНПГ | 0,257 | 0,003 | |
| NT-proBNP | 0,220 | 0,038 |
Примечание: * – корреляционная связь статистически значима.
С помощью метода бинарной логистической регрессии нами разработана прогностическая модель для определения вероятности госпитализации с СН у пациентов после первого ОИМ и ЧКВ с учетом изучаемых параметров. Модель описывается уравнением (1):
P = 1 / (1 + e—z) × 100% (1)
z = 2,170–0,291 GLS = –0,155 GCW = –0,131 ΔФВ ЛЖ,
где P – вероятность госпитализации с СН (%), GLS – модуль глобальной продольной деформации (%); GCW – глобальная полезная работа (мм рт. ст. %) / 100, ΔФВ ЛЖ – перипроцедурное увеличение ФВ ЛЖ (%).
Полученная регрессионная модель является статистически значимой (p = 0,001). Исходя из значения коэффициента детерминации Найджелкерка 17,3% дисперсии вероятности госпитализации с СН определяются факторами, включенными в модель (1). Данная модель разработана с поправкой на GWI, GWW, GWE, наличие перипроцедурной динамики ФВ ЛЖ, ИОЛП, E/e′, СДЛА.
Исходя из значений регрессионных коэффициентов GLS, GCW и ΔФВ ЛЖ имеют обратную связь с вероятностью госпитализации с СН. Характеристики каждого из факторов представлены в таблице 5.
Таблица 5
Характеристики связи предикторов модели (1) с вероятностью госпитализации с СН в отдаленном периоде наблюдения у пациентов после первого ОИМ
| Предикторы | ОШ; 95% ДИ | p |
| Модуль GLS | 0,75; 0,61–0,92 | 0,006* |
| GCW | 0,85; 0,74–0,99 | 0,036* |
| ΔФВ ЛЖ | 0,88; 0,78–0,99 | 0,040* |
Примечание: * – влияние предиктора статистически значимо (p < 0,05).
На рисунке 4 сопоставлены значения скорректированного отношения шансов (ОШ) с 95% ДИ для изучаемых факторов, вошедших в модель (1).
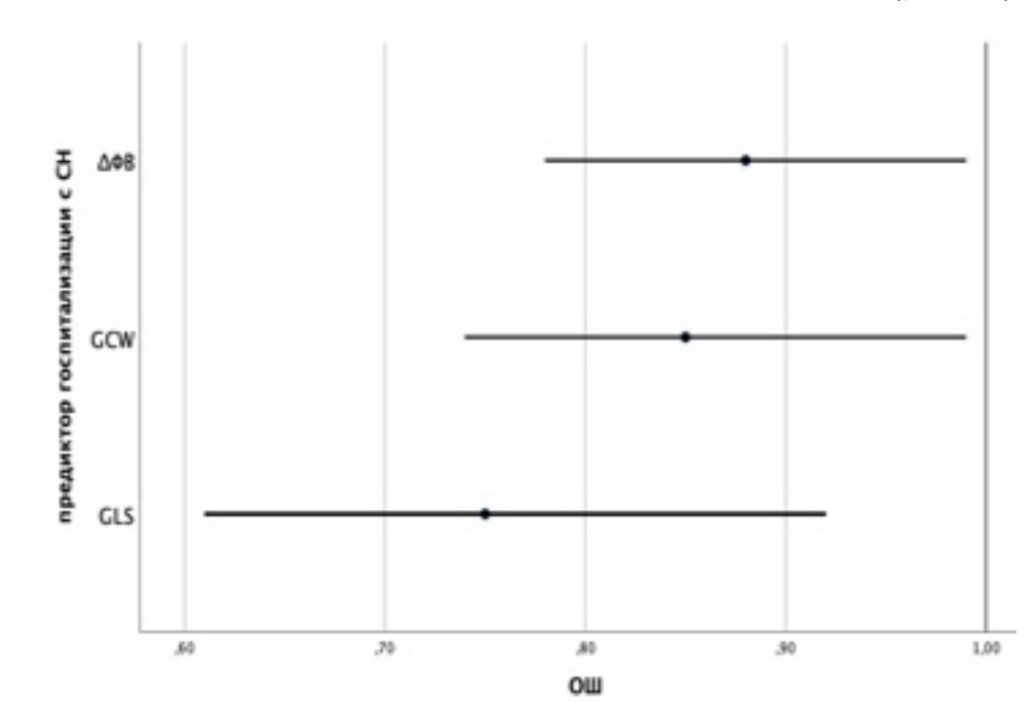
Рисунок 5. Оценки ОШ с 95% ДИ для изучаемых предикторов модели (1) госпитализации с СН.
Таким образом, снижение GLS на 1% уменьшает шанс госпитализации с СН в 1,33 раза; увеличение показателя глобальной конструктивной работы на 100 мм рт. ст. % уменьшает шанс развития исхода в 1,18 раз; увеличение исходной ФВ ЛЖ после ЧКВ на 1% – в 1,14 раза. Пороговое значение логистической функции P (1) было определено с помощью анализа ROC-кривой (рис. 6).
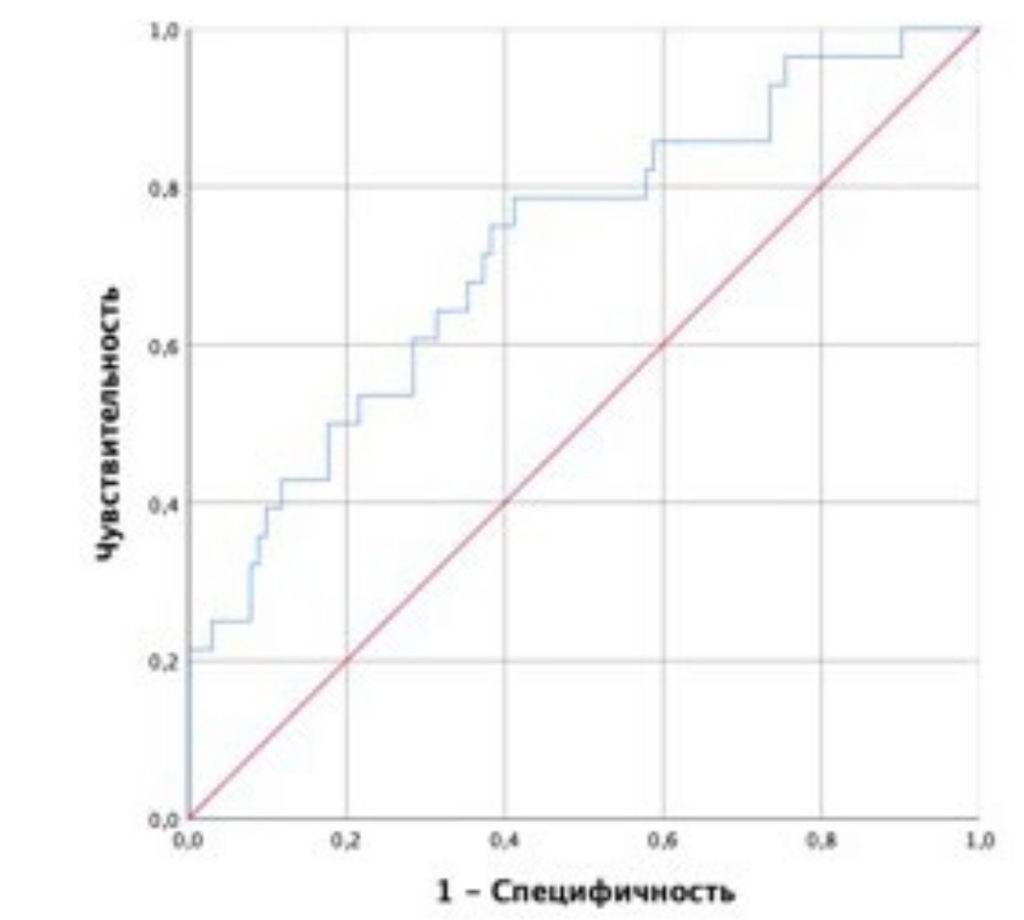
Рисунок 6. ROC-кривая, характеризующая зависимость вероятности госпитализации с СН от значений прогностической функции (1).
Площадь под ROC-кривой составила 0,72 ± 0,05 (95% ДИ: 0,62–0,83). Значение логистической функции (1) в точке cut-off составило 23,8%. При значениях P (1) выше или равных 23,8% определялся высокий риск госпитализации по поводу СН, а при меньших значениях Р (1) – низкий риск. Чувствительность и специфичность модели (1) при данном пороговом значении составили 64,3 и 71,8%, соответственно.
Бессобытийная выживаемость пациентов без госпитализации с СН, в зависимости от значения прогностической модели Р (1), была сопоставлена в группе с уровнем Р более и менее порогового значения с помощью кривых Каплана – Мейера (рис. 7). Видно, что накопленное выживание без госпитализации с СН в данных группах максимально различается в период от 3 месяцев до 1,5 года и затем через 2 и более года после ОИМ.
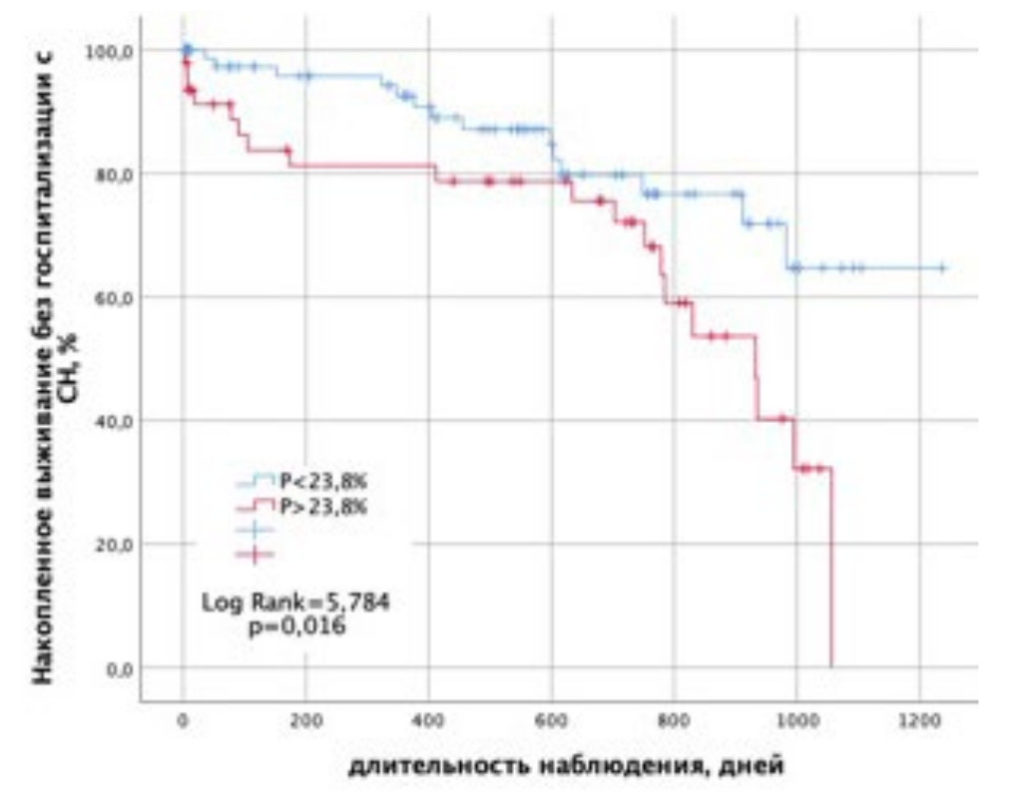
Рисунок 7. Кривые Каплана – Майера кумулятивной вероятности выживания без госпитализации с СН в зависимости от значения прогностической функции Р (1).
Клинический пример применения прогностической модели (табл. 6).
Таблица 6
Сравнительная характеристика пациентов с применением прогностической модели
| Пациент А. | Пациент Ш. | |
| При поступлении | Женщина, 64 лет, ИМпST, однососудистое поражение, ЧКВ, TIMI III | Женщина, 58 лет, ИМпST, однососудистое поражение, ЧКВ, TIMI III |
| Предикторы | ГБ в анамнезе 470 м в Т6МХ ИОЛП 29 мл/м2 (< 34 мл/м2) Исходная ФВ 44% ΔФВ ЛЖ 5% GLS –16% GCW 1700 мм рт. ст. % GWW 143 мм рт. ст. | ГБ в анамнезе 400 м в Т6МХ ИОЛП 32 мл/м2 (< 34 мл/м2) Исходная ФВ 40% ΔФВ ЛЖ 1% GLS –10% GCW1350 мм рт. ст. % GWW 215 мм рт. ст. |
| Значение Р | z = 2,17–0,291 × 16–0,155 × 1,7–0,131 × 5 = –3,405 e-(-3,405) = e3,405 = 30,1 P = 1/31,1 = 3,2%, что менее порогового уровня 23,8% – риск низкий | z = 2,17–0,291 × 10–0,155 × 1,35–0,131 × 1 = –1,08 e-(-1,08) = e1,08 = 2,94 P = 1/3,94 = 25,4%, что более порогового уровня 23,8% – риск высокий |
| Исход за срок наблюдения | Не зарегистрирован | Госпитализация с СН через 291 день после ОИМ |
Значимого влияния изучаемых параметров на развитие других исходов не выявлено.
Обсуждение
В нашем исследовании впервые предпринята попытка оценить прогностическое значение краткосрочной перипроцедурной динамики ФВ ЛЖ среди пациентов после первого ИМ и ЧКВ с разной исходной выраженностью систолической дисфункции ЛЖ. Кроме того, были изучены связь между различными показателями миокардиальной работы, перипроцедурной динамикой ФВ ЛЖ и их влияние на долгосрочный прогноз у данной категории пациентов.
Основные выводы настоящего исследования можно суммировать следующим образом: у пациентов после первого ОИМ и ЧКВ, которые в течение 1,5 года наблюдения были госпитализированы с развитием СН или умерли от сердечно-сосудистого заболевания, регистрировалось более низкое значение GWE, статистически значимо бóльшие значения GWW, GLS, реже регистрировался перипроцедурный прирост ФВ ЛЖ более 5%. По остальным показателям, в том числе потенциально влияющим на возможность развития СН (СД в анамнезе, подъем сегмента ST, одно- и многососудистое поражение коронарного русла, уровни NTproBNP и тропонина), статистически значимых различий выявлено не было. Показаны направление, сила, теснота и статистическая значимость корреляционных связей между значениями миокардиальной работы и динамическими показателями сократительной способности ЛЖ до и после ЧКВ. Разработанная нами прогностическая модель (1) для расчета вероятности госпитализации с СН (в %), включает GLS, GCW и ΔФВ ЛЖ; эти предикторы оставались значимыми при включении в многофакторную модель всех важных ограничивающих переменных, в том числе других показателей миокардиальной работы, исходных значений ФВ ЛЖ, наличие перипроцедурной динамики ФВ ЛЖ, ИОЛП, E/e′, СДЛА, степень митральной регургитации, линейные и объемные показатели ЛЖ. При однофакторном регрессионном анализе получена зависимость госпитализации по поводу развития СН от значений GLS < –13,7% и GWW > 161,5 mmHg%.
В современных исследованиях все чаще подтверждается прогностическая роль восстановления ФВ ЛЖ у пациентов после перенесенного ИМ в отношении развития неблагоприятных исходов. Так Marcos F. Minicucci et al. [16] выявили, что восстановление функции ЛЖ происходит в период от 2 недель до 6 месяцев у 25% пациентов после ИМ. Wanda Y. Wu и соавт. [12, 17] показали 8-кратное снижение смертности от всех причин и 10-кратное снижение ССС у молодых пациентов с ОИМ с улучшенной ФВ ЛЖ. Chew и соавт. [13, 18] также обнаружили, что пожилые пациенты с ИМ и улучшением ФВ ЛЖ до > 40% в период от 2 недель имели в 4 раза более низкий риск будущих нежелательных явлений и смертности от всех причин и ССЗ по сравнению с пациентами без динамики ФВ ЛЖ. Руководства рекомендуют проводить стандартную эхокардиографию перед выпиской всем пациентам с ИМпЅТ для оценки ФВ и диастолической функции ЛЖ, а также других параметров, которые могут повлиять на прогноз. Однако рекомендации менее ясны в отношении того, когда именно ФВ ЛЖ следует оценивать в динамике [1].
Недавние исследования подтвердили, что GLS, измеренная с помощью спекл-трекинг Эхо-КГ [19] и магнитно-резонансной томографии сердца [20], имеет также важное прогностическое значение у пациентов после ИМ. Однако, как и ФВ ЛЖ, GLS также зависит (хотя и в меньшей степени) от уровня нагрузки, особенно от постнагрузки [21]. Оценка параметров миокардиальной работы, по сравнению со стандартными параметрами функции ЛЖ, объединяет GLS, постнагрузку и фазу изоволюмического расслабления, что позволяет получить более точную оценку работы миокарда ЛЖ. Более того, эти показатели коррелируют с метаболизмом глюкозы в миокарде, что позволяет оценить энергетические характеристики миокарда ЛЖ [10]. El Mahdiui и соавт. обнаружили, что у пациентов с ИМпЅТ наблюдались более низкие значения GWE по сравнению со здоровыми людьми и пациентами с наличием факторов риска сердечно-сосудистых заболеваний [22]. S. Roemer и соавт. в исследовании на 507 пациентах с ИМпЅТ показали, что снижение GWE < 86%, измеренное в течение 48 часов после госпитализации, связано с худшей выживаемостью в долгосрочной перспективе [15]. Вероятно, это связано с тем, что после ИМпЅТ ишемия вызывает изменения в метаболизме миокарда, снижая образование АТФ [23], что приводит к нарушению сократительной функции ЛЖ и снижению значений миокардиальной работы.
Эффективность работы миокарда зависит от способности сердца потреблять кислород и параметров метаболизма миокарда [24]. При неблагоприятных изменениях обменных процессов в связи с ишемическим повреждением ожидается снижение показателей эффективной работы миокарда, в том числе за счет повышения показателя напрасной работы. В настоящее время прогностические значения показателей миокардиальной работы у пациентов с ОИМ изучены недостаточно. Однако предыдущие исследования показывали связь данных параметров с прогнозом в различных популяциях. S.C. Butcher и соавт. показали, что у 197 пациентов с ФВ ЛЖ ≤ 40% после ИМпST более высокие значения GWI ЛЖ были связаны с большей вероятностью нормализации ФВ ЛЖ через 6 месяцев наблюдения. Кроме того, более низкие значения GWI ЛЖ были независимо связаны с повышенной смертностью от всех причин при длительном наблюдении [25, 27]. van der Bijl и соавт. проанализировали прогностическую роль GWE у 153 пациентов с СН при наличии показаний к ресинхронизации [26]. Авторы показали, что GWE < 75%, измеренная до проведения сердечной ресинхронизирующей терапии, ассоциировалась с лучшим долгосрочным исходом.
Настоящее исследование предоставляет дополнительные доказательства прогностической значимости параметров миокардиальной работы, в частности GWW, в когорте пациентов с первым ОИМ и ЧКВ, показывая, что пациенты со повышенной GWW имели худший прогноз при долгосрочном наблюдении. Интересно, что более низкие значения GWW были связаны с лучшим исходом, независимо от других клинических параметров. Кроме того, GCW с высоким показателем значимости был включен в прогностическую модель для определения вероятности госпитализации по поводу СН наряду с перипроцедурной динамикой ФВ ЛЖ и показателем GLS.
Выводы
Таким образом, у пациентов с первым ОИМ и успешным ЧКВ целесообразно использовать прогностическую модель, включающую показатели GCW, GLS и ΔФВ ЛЖ, с целью стратификации пациентов по риску госпитализации с СН в постинфарктном периоде.
Ограничения и перспективы исследования
Наше исследование было одноцентровым, ограничено малой выборкой и относительно коротким сроком наблюдения. Кроме того, выборка включала пациентов с ИМ как с так и без подъема сегмента ST, как с одно-, так и многососудистым поражением коронарных артерий.
Список литературы / References
- Ibanez B, James S, Agewall S, Antunes MJ, Bucciarelli-Ducci C, Bueno H, Caforio ALP, Crea F, Goudevenos JA, Halvorsen S, et al. 2017 ESC guidelines for the management of acute myocardial infarction in patients pre- senting with ST-segment elevation: the task force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 2018; 39: 119–177. DOI: 10.1093/eurheartj/ehx393.
- Townsend N, Wilson L, Bhatnagar P, Wickramasinghe K, Rayner M, Nichols M. Cardiovascular disease in Europe: Epidemiological update 2016. Eur Heart J 2016; 37: 3232–45.
- van der Bijl P, Abou R, Goedemans L, Gersh BJ, Holmes DR Jr, Ajmone Marsan N, Delgado V, Bax JJ. Left ventricular post-infarct remodeling: Implications for systolic function improvement and outcomes in the modern era. JACC Heart Fail. 2020; 8: 131–140. DOI: 10.1016/j.jchf.2019.08.014.
- Stone GW, Selker HP, Thiele H, Patel MR, Udelson JE, Ohman EM, Maehara A, Eitel I, Granger CB, Jenkins PL, et al. Relationship between infarct size and outcomes following primary PCI: Patient-level analysis from 10 randomized trials. J Am Coll Cardiol. 2016; 67: 1674–83. DOI: 10.1016/j.jacc.2016.01.069.
- Hall TS, von Lueder TG, Zannad F, Rossignol P, Duarte K, Chouihed T, Dickstein K, Atar D, Agewall S, Girerd N; High-Risk Myocardial Infarction Database Initiative Investigators. Relationship between left ventricular ejection fraction and mortality after myocardial infarction complicated by heart failure or left ventricular dysfunction. Int J Cardiol. 2018; 272: 260–266. DOI: 10.1016/j.ijcard.2018.07.137.
- Marwick TH. Ejection fraction pros and cons: JACC state-of-the-art review. J Am Coll Cardiol. 2018; 72: 2360–2379. DOI: 10.1016/j.jacc.2018.08.2162.
- Munk K, Andersen NH, Terkelsen CJ, Bibby BM, Johnsen SP, Bøtker HE, Nielsen TT, Poulsen SH. Global left ventricular longitudinal systolic strain for early risk assessment in patients with acute myocardial infarction treated with primary percutaneous intervention. J Am Soc Echocardiogr. 2012; 25: 644–651. DOI: 10.1016/j.echo.2012.02.003.
- Antoni ML, Mollema SA, Delgado V, Atary JZ, Borleffs CJ, Boersma E, Holman ER, van der Wall EE, Schalij MJ, Bax JJ. Prognostic importance of strain and strain rate after acute myocardial infarction. Eur Heart J. 2010; 31: 1640–7. DOI: 10.1093/eurheartj/ehq105.
- Roth GA, Johnson C, Abajobir A, Abd-Allah F, Abera SF, Abyu G et al. Global, regional, and national burden of cardiovascular diseases for 10 causes, 1990 to.2015. J Am Coll Cardiol 2017; 70: 1–25.
- Russell K, Eriksen M, Aaberge L, Wilhelmsen N, Skulstad H, Remme EW et al. A novel clinical method for quantification of regional left ventricular pressure-strain loop area: a non-invasive index of myocardial work. Eur Heart J 2012; 33: 724–33.
- Abou R, Leung M, Goedemans L, Hoogslag GE, Schalij MJ, Marsan NA et al. Effect of guideline-based therapy on left ventricular systolic function recovery. after ST-segment elevation myocardial infarction. Am J Cardiol 2018; 122: 1591–7.
- Wu WY, Biery DW, Singh A, Divakaran S, Berman AN, Ayuba G, DeFilippis EM, Nasir K, Januzzi JL, Di Carli MF, Bhatt DL, Blankstein R. Recovery of Left Ventricular Systolic Function and Clinical Outcomes in Young Adults with Myocardial Infarction. J Am Coll Cardiol. 2020 Jun 9; 75 (22): 2804–2815. DOI: 10.1016/j.jacc.2020.03.074.
- Chew DS, Heikki H, Schmidt G, Kavanagh KM, Dommasch M, Bloch Thomsen PE et al. Change in left ventricular ejection fraction following first myocardial in- farction and outcome. JACC Clin Electrophysiol 2018; 4: 672–82.
- Nagueh SF, Smiseth OA, Appleton CP, Byrd BF 3rd, Dokainish H, Edvardsen T, Flachskampf FA, Gillebert TC, Klein AL, Lancellotti P, Marino P, Oh JK, Popescu BA, Waggoner AD. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2016 Apr; 29 (4): 277–314. DOI: 10.1016/j.echo.2016.01.011.
- Roemer S, Jaglan A, Santos D, Umland M, Jain R, Tajik AJ, Khandheria BK. The Utility of Myocardial Work in Clinical Practice. J Am Soc Echocardiogr. 2021 Aug; 34 (8): 807–818. Epub 2021 Apr 22. PMID: 33895250. DOI: 10.1016/j.echo.2021.04.013.
- Minicucci MF, Farah E, Fusco DR, Cogni AL, Azevedo PS, Okoshi K, Zanati SG, Matsubara BB, Paiva SA, Zornoff LA. Infarct size as predictor of systolic functional recovery after myocardial infarction. Arq Bras Cardiol. 2014 Jun; 102 (6): 549–56. DOI: 10.5935/abc.20140051.
- Colvin MM, Sutton NR. Left Ventricular Recovery in Young Patients with Myocardial Infarction: How Much Is Enough? J Am Coll Cardiol. 2020 Jun 9; 75 (22): 2816–2818. DOI: 10.1016/j.jacc.2020.04.020.
- Chew DS, Wilton SB, Kavanagh K, Southern DA, Tan-Mesiatowsky LE, Exner DV; APPROACH Investigators. Left ventricular ejection fraction reassessment post-myocardial infarction: Current clinical practice and determinants of adverse remodeling. Am Heart J. 2018 Apr; 198: 91–96. DOI: 10.1016/j.ahj.2017.11.014.
- Ersbøll M, Valeur N, Mogensen UM, Andersen MJ, Møller JE, Hassager C, Søgaard P, Køber L. Relationship between left ventricular longitudinal de- formation and clinical heart failure during admission for acute myocardial infarction: a two-dimensional speckle-tracking study. J Am Soc Echocar- diogr. 2012; 25: 1280–1289. DOI: 10.1016/j.echo.2012.09.006.
- Gavara J, Rodriguez-Palomares JF, Valente F, Monmeneu JV, Lopez- Lereu MP, Bonanad C, Ferreira-Gonzalez I, Garcia Del Blanco B, Rodriguez- Garcia J, Mutuberria M, et al. Prognostic value of strain by tissue tracking cardiac magnetic resonance after ST-segment elevation myocardial infarction. JACC Cardiovasc Imaging. 2018; 11: 1448–1457. DOI: 10.1016/j. jcmg.2017.09.017.
- Boe E, Russell K, Eek C, Eriksen M, Remme EW, Smiseth OA, Skulstad H. Non-invasive myocardial work index identifies acute coronary occlusion in patients with non-ST-segment elevation-acute coronary syndrome. Eur Heart J Cardiovasc Imaging. 2015; 16: 1247–1255. DOI: 10.1093/ehjci/jev078.
- El Mahdiui M, van der Bijl P, Abou R, Ajmone Marsan N, Delgado V, Bax JJ. Global left ventricular myocardial work efficiency in healthy individuals and patients with cardiovascular disease. J Am Soc Echocardiogr. 2019; 32: 1120–1127. DOI: 10.1016/j.echo.2019.05.002.
- Lopaschuk GD, Ussher JR, Folmes CD, Jaswal JS, Stanley WC. Myocardial fatty acid metabolism in health and disease. Physiol Rev. 2010; 90: 207–258. DOI: 10.1152/physrev.00015.2009.
- Sörensen J, Harms HJ, Aalen JM, Baron T, Smiseth OA, Flachskampf FA. Myocardial efficiency: a fundamental physiological concept on the verge of clinical impact. JACC Cardiovasc Imaging. 2020; 13: 1564–1576. DOI: 10.1016/j.jcmg.2019.08.030.
- Butcher SC, Lustosa RP, Abou R, Marsan NA, Bax JJ, Delgado V. Prognostic implications of left ventricular myocardial work index in patients with ST-segment elevation myocardial infarction and reduced left ventricular ejection fraction. Eur Heart J Cardiovasc Imaging. 2022 Apr 18; 23 (5): 699–707. PMID: 33993227. DOI: 10.1093/ehjci/jeab096.
- van der Bijl P, Vo NM, Kostyukevich MV, Mertens B, Ajmone Marsan N, Delgado V, Bax JJ. Prognostic implications of global, left ventricular myocardial work efficiency before cardiac resynchronization therapy. Eur Heart J Cardiovasc Imaging. 2019; 20: 1388–1394. DOI: 10.1093/ehjci/jez095.
- Lustosa RP, Butcher SC, van der Bijl P, El Mahdiui M, Montero-Cabezas JM, Kostyukevich MV, Rocha De Lorenzo A, Knuuti J, Ajmone Marsan N, Bax JJ, Delgado V. Global Left Ventricular Myocardial Work Efficiency and Long-Term Prognosis in Patients After ST-Segment-Elevation Myocardial Infarction. Circ Cardiovasc Imaging. 2021 Mar; 14 (3): e012072. DOI: 10.1161/circimaging.120.012072.
Тимофеева Татьяна Михайловна, врач функциональной диагностики1, ассистент кафедры2. E-mail: timtan@bk.ru. ORCID:
Сафарова Айтен Фуад Кызы, д.м.н., врач функциональной диагностики1, проф. кафедры2. E-mail: aytensaf@mail.ru. ORCID:
Кобалава Жанна Давидовна, д.м.н., проф., член-корр. РАН, зав. кафедрой кафедры2. E-mail: zkobalava@mail.ru. ORCID:
Ефимова Виктория Павловна, к.м.н., зав. отделением ультразвуковых и функциональных методов диагностики1. E-mail:. ORCID:
Лобжанидзе Тина Викторовна, к.м.н., доцент2. ORCID:
Озова Елена Меджидовна, к.м.н., врач функциональной диагностики1, ассистент2. ORCID:
1ГБУЗ «Городская клиническая больница имени В.В. Виноградова Департамента здравоохранения Москвы», Москва
2Кафедра внутренних болезней с курсом кардиологии и функциональной диагностики имени академика В.С. Моисеева медицинского института ФГАОУ ВО «Российский университет дружбы народов», Москва
Автор для переписки: Тимофеева Татьяна Михайловна. E-mail: timtan@bk.ru
About authors
Timofeeva Tatyana M., doctor of functional diagnostics1, assistant2. E-mail: timtan@bk.ru. ORCID:
Safarova Ayten F.K., DM Sci (habil.), doctor of functional diagnostics1, professor2. E-mail: aytensaf@mail.ru. ORCID:
Kobalava Zhanna D., DM Sci (habil.), professor, head of Dept2. E-mail: zkobalava@mail.ru. ORCID:
Efimova Victoria P., PhD Med, head of Dept of Ultrasound and Functional Diagnostic Methods1. ORCID:
Lobzhanidze Tina V., PhD Med, associate professor2. ORCID:
Ozova Elena M., PhD Med, doctor of functional diagnostics1, assistant2. ORCID:
1City Clinical Hospital n.a. V.V. Vinogradov, Moscow, Russia
2Peoples’ Friendship University of Russia, Dept of Internal Diseases with a course of cardiology and functional diagnostics n.a. academician V.S. Moiseev, Moscow, Russia
Corresponding author: Timofeeva Tatyana M. E-mail: timtan@bk.ru

