В.И. Мазуров1, И.Б. Беляева1, Е.А. Трофимов1, И.В. Октябрьская2, Р.Р. Самигуллина1, А.Л. Чудинов1,2, О.В. Инамова1,2
1ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И.И. Мечникова» Минздрава России, Санкт-Петербург
2СПб ГБУЗ «Клиническая ревматологическая больница № 25», Санкт-Петербург
РЕЗЮМЕ
Цель. Изучить влияние различных средств базисной и генно-инженерной биологической терапии (инфликсимаб, ритуксимаб, тоцилизумаб), применяемых в качестве средств первой, второй и третьей линий в комбинации с метотрексатом на клиническое течение, качество жизни (КЖ), показатели стрессоустойчивости и эволюцию суставных эрозий и синовита у больных ревматоидным артритом (РА) в течение 12 месяцев наблюдения.
Материал и методы. Данная работа представляет собой открытое наблюдательное исследование эффективности и безопасности различных средств базисной и генно-инженерной биологической терапии (ГИБТ) у больных ранним активным РА, находящихся в регистре СЗГМУ имени И.И. Мечникова и КРБ № 25 Санкт-Петербурга. Включены 151 больной ранним РА, средний возраст – 58,2 ± 5,5 года, длительность заболевания – 6,5 ± 0,3 месяца, DAS28-СРБ – 4,48 ± 0,87. На первом этапе больным РА методом случайной выборки назначалась базисная терапия сульфасалазином (СС) 2г в сутки (группа I – 55 больных), метотрексатом (МТ) – 20 мг в неделю (группа II – 55 больных) или лефлуномидом (ЛФ) 20 мг в сутки (группа III – 41 больной). Длительность наблюдения составила 12 месяцев. На втором этапе 101 пациенту с сохраняющейся умеренной (DAS28: 3,2–5,1) и высокой степенями активности РА (DAS28 > 5,1), несмотря на проводимую терапию БПВП, назначен МТ в дозе 25 мг в неделю (подгруппа 1 – 25 больных), либо МТ – 20 мг в неделю в комбинации с инфликсимабом (ИНФ) – 3 мг/кг (подгруппа 2 – 25 больных), либо МТ 20 мг в неделю и ритуксимаб (РМ) две инфузии по 1000 мг на неделях 0 и 2, а затем на 52-й и 54-й неделях с длительностью наблюдения 12 месяцев. На третьем этапе 20 пациентов (16 женщин и 4 мужчины в возрасте от 28 до 67 лет) с высокой активностью заболевания DAS28-СРБ, несмотря на ранее проведенную терапию МТ и ИНФ или РМ, были переведены на терапию блокатором рецептора ИЛ-6 тоцилизумабом в качестве препарата второй или третьей линии. Длительность наблюдения составила от 6 месяцев до 5 лет.
Результаты. К 12 месяцам лечения БПВП клиническая ремиссия достигалась чаще в группе МТ, чем в группе ЛФ (43,2 и 32,4%) (p < 0,05), и сопровождалась снижением экспрессии маркеров ранней активации Т-лимфоцитов ИЛ-1β, ИЛ-2 и ИЛ-4. В группе СС клиническая ремиссия не наблюдалась, при этом отмечался достоверный прирост медианы общего счета Шарпа и счета эрозий относительно исходных показателей. Назначение ИНФ или РМ как первого ГИБТ через 12 месяцев приводило к значимому повышению физического и психологического компонентов КЖ пациентов и положительной динамике индекса HAQ по сравнению с исходными значениями. Применение тоцилизумаба как препарата второй и третьей линии терапии у пациентов с активным РА и неэффективностью предшествующей терапии БПВП и ГИБП способствовало достоверному снижению DAS28-СРБ уже к 24-й неделе наблюдения. Случаев серьезных нежелательных реакций (НР) не отмечено.
Выводы. Между группами больных, получавших биологическую терапию ИНФ и РМ, не выявлено статистически значимых различий в динамике СРБ, СОЭ, ЦИК и показателей рентгенологического прогрессирования, что подтверждает возможность «переключения» терапии с первого ГИБП на препараты последующих линий при нарастании клинической активности РА. Тоцилизумаб может быть препаратом второй и третьей линии при ускользании эффекта от терапии другими ГИБП.
КЛЮЧЕВЫЕ СЛОВА: ревматоидный артрит, инфликсимаб, ритуксимаб, тоцилизумаб, стратегия T2T.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы заявляют об отсутствии конфликта интересов.
Comparative evaluation of effect of various means of basic and genetically engineered biological therapy on clinical course, rate of development of osteodestructive changes, quality of life and state of stress resistance in patients with rheumatoid arthritis (open observational study)
V.I. Mazurov1,2, I.B. Belyaeva1,2, Е.А. Trofimov1, I.V. Oktyabrskaya2, R.R. Samigullina1, A.L. Chudinov1,2, O.V. Inamova1,2
1North-West State Medical University n.a. I.I. Mechnikov, Saint-Petersburg, Russia
2Clinical Rheumatology Hospital No. 25, Saint-Petersburg, Russia
SUMMARY
Objective. To study the effect of various basic and genetic engineering biological therapies (infliximab, rituximab, tocilizumab) used as first, second- and third-line drugs in combination with methotrexate on clinical course, quality of life (QOL), and the evolution of articular erosions and synovitis in patients with rheumatoid arthritis (RA) during 12 months of follow-up.
Material and methods. This paper is an open observational study of the efficacy and safety of various basic and genetic engineering biological therapy agents (bDMARD) in patients with early active RA who are in the North-West State Medical University n.a. I.I. Mechnikov registry. Included are 151 patients with early RA (eRA), the average age is 58.2 ± 5.5 years, the disease duration is 6.5 ± 0.3 months, DAS28-CRP – 4.48 ± 0.87. At the first stage, basic therapy was administered to patients with eRA by random sampling: sulfasalazine (CC) 2 g per day (group I – 55 patients), methotrexate (MT) – 20 mg per week (group II – 55 patients), or leflunomide (LF) 20 mg per day (group III – 41 patients). The follow-up was 12 months. At the second stage, 101 patients with persisting moderate (DAS28: 3.2–5.1) and high levels of RA activity (DAS28 > 5.1) despite ongoing therapy with DMARDs were assigned MT at a dose of 25 mg per week (subgroup 1 – 25 patients ), or MT – 20 mg per week in combination with infliximab (INF) – 3 mg/kg (subgroup of 2–25 patients), or – MT 20 mg per week and rituximab (RM) – two infusions of 1000 mg at the week 0 and 2 and then at the week 52nd and 54th with a duration of observation of 12 months. In the third stage, 20 patients (16 women and 4 men aged 28 to 67 years) with a high disease activity DAS28-CRP despite previous therapy with MT and INF or RM were transferred to therapy with an IL6 – tocilizumab receptor blocker as a second-line or third-line drug. The duration of observation ranged from 6 months to five years.
Results. By 12 months of treating DMARDs, clinical remission was achieved more often in the MT group than in the LF group (43.2 and 32.4%) (p < 0.05), and was accompanied by a decrease in the expression of markers of early activation of T-lymphocytes, IL-1β, IL-2 and IL-4. In the SS group, clinical remission was not observed, while there was a significant increase in the median of the total Sharpe score and erosion score relative to the baseline. The prescription of INF or PM as the first bDMARD after 12 months led to a significant increase in the physical and psychological components of the patients’ QL and positive dynamics of the HAQ index compared to baseline values. The use of tocilizumab as a second-line and third-line drug in patients with active RA and the ineffectiveness of previous therapy for DMARD and bDMARD contributed to a significant decrease in DAS28-CRP by as early as 24 weeks of follow-up. Cases of serious adverse reactions (AE) are not marked.
Conclusions. There were no statistically significant differences in the dynamics of CRP, ESR, circulating immune complex and X-ray progression indicators between the groups of patients who received biological therapy of INF and RM, which confirms the possibility of ‘switching’ therapy from the first bDMARD to the drugs of subsequent lines with an increase in the clinical activity of RA. Tocilizumab can be a second- and third-line drug with an ‘escape’ effect from other bDMARDs.
KEYWORDS: rheumatoid arthritis, infliximab, rituximab, tocilizumab, T2T strategy.
CONFLICT OF INTEREST. The authors declare no conflict of interest.
Введение
Современная стратегия лечения РА базируется на его ранней диагностике, которая определяет возможность как можно раньше (окно возможности) инициировать активную терапию, целью которой является максимально быстрое достижение ремиссии (концепция «Лечение до достижения цели») [1, 2]. В контексте рекомендаций EULAR 2020 года особое внимание уделено применению базисных болезнь-модифицирующих антиревматических препаратов (БПВП). Отмечено, что терапия БПВП должна быть начата, как только диагноз РA будет установлен. Сделаны выводы о том, чтометотрексат (МТ) продолжает оставаться основным (первым) препаратом для лечения пациентов с РА как в виде монотерапии, так и в сочетании с другими БПВП и генно-инженерными биологическими препаратами (ГИБП) [3, 4]. Следует отметить, что во всех исследованиях, посвященных оценке эффективности фармакотерапии раннего РА (рРА), единственным БПВП являлся МТ, с которым сравнивается эффективность всех методов лечения. Другие БПВП – лефлуномид (ЛФ) и сульфасалазин (СС) рассматриваются в качестве альтернативы МТ только у пациентов, имеющих противопоказания к назначению МТ [5–8]. Однако контролируемые исследования, касающиеся эффективности моно- или комбинированной терапии ЛФ и СС при раннем РА в рамках стратегии «Лечение до достижения цели» немногочисленны.
Внедрение в клиническую практику генно-инженерных биологических препаратов (ГИБП) и таргетных средств привело к изменению стратегической цели терапии РА – достижению ремиссии и замедлению прогрессирования деструктивного процесса в суставах, а не только симптоматическому улучшению течения РА. К ГИБП, официально зарегистрированным в России для лечения РА, относят класс ингибиторов фактора некроза опухоли α (ФНО-α) этанерцепт, инфликсимаб, адалимумаб, голимумаб и цертолизумаба пэгол; ингибиторы рецепторов ИЛ-6 тоцилизумаб, сарилумаб, левилимаб; ингибитор ИЛ-6 олокизумаб; анти-В-клеточный препарат ритуксимаб, а также блокатор активации Т-лимфоцитов абатацепт. Наряду с ГИБП особое место в лечении РА занимают ингибиторы JAK-киназ тофацитиниб (ТОФА), барицитиниб, упадацитиниб [9–12]. Однако сравнительных исследований по оценке клинической эффективности различных ГИБП и таргетных средств на клиническое течение, качество жизни, стрессоустойчивость и скорость эволюции суставных эрозий и синовита у пациентов с РА крайне мало.
Данная работа представляет собой открытое наблюдательное исследование эффективности и безопасности различных средств базисной и генно-инженерной биологической терапии у больных ранним активным РА, находящихся в регистре СЗГМУ им. И.И. Мечникова и Клинической ревматологической больницы № 25 Санкт-Петербурга.
Целью исследования явилась сравнительная оценка показателей клинической активности, иммунологических параметров, показателей рентгенологического и МРТ прогрессирования заболевания и качества жизни и показателей стрессоустойчивости у пациентов с рРА при применении базисных препаратов (СС, МТ и ЛФ), ГИБП (ИНФ или РТМ в качестве первой или второй линии и тоцилизумаба в качестве второй и третьей линии) в комбинации с МТ у больных с активным течением РА.
Материал и методы
Проведено клинико-лабораторное и инструментальное обследование 151 больного рРА. Диагноз РА был установлен по критериям EULAR и ACR (2010) [11, 12]. Длительность заболевания на момент первичного обследования составляла от 3 недель до 12 месяцев и была в среднем 6,5 ± 0,3 месяца. Средний возраст больных составил 58,2 ± 5,5 года. Большая часть (51,2%) больных рРА была серонегативной по ревматоидному фактору (РФ). Антитела к циклическим цитруллинированным пептидам (АЦЦП) выявлялись у 76% пациентов. Среди обследованных преобладали средняя и высокая степени активности иммуновоспалительного процесса по DAS28-СРБ – 4,48 ± 0,87; I–II рентгенологические стадии заболевания по классификации Штейнброкера (23,2 и 60,5% соответственно) и II функциональный класс РА (59,7%).
После установления диагноза рРА больным методом случайной выборки была назначена базисная терапия: группа I (55 больных) в качестве базисной терапии получала СС в дозе 2 г в сутки; группа II (55 больных) получала МТ per os или внутримышечно в дозе 20 мг в неделю; группа III (41 больной) получала лефлуномид (ЛФ) 100 мг в сутки 3 дня, затем по 20 мг в сутки.
Наряду с базисной терапией всем больным назначался один из нестероидных противовоспалительных препаратов (НПВП). Длительность наблюдения составила 12 месяцев. Второй этап исследования заключался в отборе 101 пациента с РА с умеренной (DAS28: 3,2–5,1) и высокой степенями активности болезни (DAS28 > 5,1), несмотря на проводимую терапию СС, МТ и ЛФ через 12 месяцев (78% женщин, 22% мужчин). Обследованные пациенты были разделены на три подгруппы. Первую подгруппу составили 25 больных РА, получавших стандартную базисную терапию – МТ в дозе 25 мг в неделю. Вторую подгруппу составили 25 больных РА, получавших комбинированную терапию МТ в дозе 20 мг в неделю и инфликсимаб в дозе 3 мг/кг внутривенно капельно по схеме: исходно, через 2, 6 недель и далее каждые 8 недель. В третью подгруппу вошел 51 больной РА (из них 26 [50,9%] больных, «наивных» по ГИБТ, и 25 [49,1%] больных, ранее находившихся на терапии ИНФ), получавшие комбинированную терапию МТ в дозе 15–20 мг в неделю и ритуксимаб две инфузии по 1000 мг на неделях 0 и 2, а затем 52-й и 54-й. С целью профилактики аллергических реакций всем пациентам проводилась медикаментозная премедикация – внутривенное введение глюкокортикоидов из расчета 1 мг/кг массы тела, антигистаминных препаратов и парацетамола. По показаниям больным назначались преднизолон в дозе 5–10 мг в сутки и нестероидные противовоспалительные препараты (нимесулид, диклофенак, мелоксикам, ацеклофенак). Оценка влияния различных схем лечения на течение РА осуществлялась в динамике с длительностью наблюдения 12 месяцев.
Третий этап исследования заключался в отборе 20 пациентов с РА (16 женщин и 4 мужчин в возрасте от 28 до 67 лет) с высокой активностью заболевания (DAS28 > 5,1), несмотря на ранее проведенную терапию МТ и ИНФ или РМ. Этим пациентам был назначен блокатор рецептора ИЛ-6 тоцилизумаб (ТБ) внутривенно 4 мг/кг раз в 4 недели. Длительность наблюдения составилаот 6 месяцев до 5 лет.
Для количественной оценки активности заболевания использовался индекс Disease Activity Score (DAS28-СРБ). Для оценки функционального статуса суставов использовался индекс Health Assessment Questionnaire (HAQ). HAQ отражает функциональные возможности суставов в повседневной жизни больного РА. Качество жизни оценивалось с помощью опросника SF36, степень стрессоустойчивости – по опроснику Холмса.
Иммунологическое исследование включало определение содержания ревматоидного фактора (РФ) методом латекс-агглютинации, циркулирующих иммунных комплексов (ЦИК) методом селективной преципитации комплекса АГ-АТ с определением на спектрофотометре оптической плотности, IgA, IgМ, IgG методом жидкофазной иммунопреципитации с нефелометрической конечной точкой определения, прибор TURBOXR. Определение в динамике уровней интерлейкинов (ИЛ)-1b, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10 и фактора некроза опухоли альфа (ФНО-α) проводили с помощью диагностических наборов фирмы Randox на автоматизированном иммунохемолюминисцентном анализаторе Evidence с использованием биочиповой технологии. Оценивались фенотипические характеристики лимфоцитов (CD3+, CD4+, CD8+, CD16+, CD19+, CD25+, CD56+ и HLA-DR+) методом проточной цитометрии на проточном цитофлуориметре FACScan (Becton Dickinson, США). Уровни антител к инфликсимабу в периферической крови больных РА определяли тест-системой Anti-TNF-alpha antibodies, предназначенной для определения in vitro человеческих антител против химерных анти-ФНО-α антител в сыворотке. Рентгенологические стадии РА оценивались по классификации Штейнброкера. Оценку рентгенологического прогрессирования изменений в суставах при динамическом наблюдении через 12 месяцев проводили по методу Шарпа (1985) в модификации van der Heijde M.F.M. (1999). Для выявления характерных для РА изменений и их оценки выполнялась магнитно-резонансная томография (МРТ) обеих кистей или доминирующей клинически кисти у 68 пациентов. Исследование проводилось на магнитно-резонансном томографе Signa Infinity фирмы General Electric с напряженностью магнитного поля 1,5 Тл. МРТ-исследование выполнялось по стандартному протоколу с последующей полуколичественной оценкой структурных изменений пястно-фаланговых и запястно-пястных суставов согласно шкалам OMERACT RAMRIS EULAR. Полученные данные обработаны c помощью программы Statistica for Windows 6.0. Критерием статистической достоверности считали общепринятую в медико-биологических исследованиях величину p < 0,05.
Результаты и обсуждение
На фоне лечения СС через 12 месяцев в группе I значения индекса HAQ, СОЭ и СРБ достоверно не отличались от исходных. В группах II и III к 12-му месяцу наблюдения отмечено существенное снижение индекса HAQ, СОЭ и СРБ без достоверных различий по группам. Средние показатели активности рРА через 12 месяцев лечения по значениям DAS28-СРБ расценивались как умеренные в группе I и низкие в группах II и III. К 12 месяцам лечения в группе I клинической ремиссии РА достичь не удалось. Клиническая ремиссия (DAS28 < 2,6) достигалась чаще у больных группы II, чем у больных группы III (43,2 и 32,4%); p < 0,05 (рис. 1).
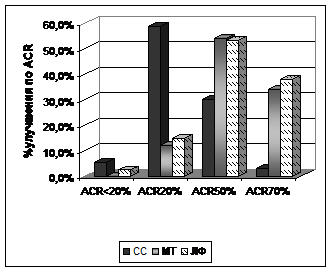
Рисунок 1. Частота клинического ответа по критериям ACR в исследуемых группах через 12 месяцев лечения.
Отмена в связи с нарастанием клинико-лабораторной активности и отрицательной рентгенологической динамикой через 12 месяцев лечения среди всех причин составила 76,3% на фоне лечения СС, 17,5% – на фоне лечения МТ и 33,4% – на фоне лечения ЛФ. Изучение динамики показателей субпопуляционного состава лимфоцитов периферической крови у больных рРА на фоне лечения БПВП исходно и через 12 месяцев показало, что терапия МТ и ЛФ ведет к снижению экспрессии маркеров ранней активации Т-лимфоцитов, которые, как известно, инициируют развитие патогенетических механизмов рРА (табл. 1).
Таблица 1
Содержание основных субпопуляций лимфоцитов в периферической крови у больных рРА до и через 12 месяцев лечения СС, МТ и ЛФ
| Препараты | Достоверность различия р | |||||||||||||
| Показатели | СС (n = 19) | МТ (n = 18) | ЛФ (n = 17) | р1–2 | р3–4 | р5–6 | ||||||||
| А | Б | А | Б | А | Б | |||||||||
| СD3+ (%) | 70,06 ± 1,39 | 70,72 ± 2,89 | 68,34 ± 4,52 | 64,72 ± 4,93 | 71,40 ± 3,39 | 71,92 ± 3,54 | Н/д | Н/д | Н/д | |||||
| СD4+ (%) | 43,50 ± 1,89 | 45,02 ± 2,01 | 46,72 ± 4,50 | 44,56 ± 2,23 | 45,50 ± 1,48 | 49,14 ± 2,68 | Н/д | Н/д | Н/д | |||||
| СD8+ (%) | 23,62 ± 0,85 | 25,41 ± 2,44 | 23,35 ± 1,97 | 28,90 ± 2,54 | 27,31 ± 1,70 | 22,71 ± 1,62 | Н/д | Н/д | Н/д | |||||
| СD4/СD8 | 1,79 ± 0,16 | 2,25 ± 0,17 | 2,17 ± 0,21 | 2,60 ± 0,84 | 1,85 ± 0,16 | 2,25 ± 0,97 | Н/д | Н/д | Н/д | |||||
| СD16+ (%) | 12,75 ± 1,61 | 17,72 ± 1,93 | 17,78 ± 2,75 | 19,35 ± 2,11 | 12,15 ± 1,45 | 17,35 ± 1,85 | Н/д | Н/д | Н/д | |||||
| СD19+ (%) | 14,42 ± 1,75 | 15,50 ± 2,77 | 16,21 ± 1,35 | 9,21 ± 2,03 | 15,31 ± 1,47 | 10,76 ± 2,15 | Н/д | Н/д | Н/д | |||||
| СD25+ (%) | 25,51 ± 2,51 | 21,13 ± 3,83 | 24,85 ± 2,21 | 16,92 ± 4,69 | 23,75 ± 1,51 | 12,80 ± 4,53 | Н/д | Н/д | * | |||||
| СD56+ (%) | 13,22 ± 0,94 | 14,07 ± 1,08 | 14,46 ± 1,23 | 15,22 ± 1,02 | 14,73 ± 1,11 | 16,87 ± 1,46 | Н/д | Н/д | Н/д | |||||
| HLA-DR+ (%) | 14,21 ± 1,59 | 13,21 ± 1,53 | 16,61 ± 1,47 | 14,32 ± 2,03 | 13,25 ± 1,39 | 15,76 ± 3,41 | Н/д | Н/д | Н/д | |||||
Примечание: А – исходные значения; Б – значения через 12 месяцев; * – р < 0,05; Н/д – различия статистически недостоверны.
Через 12 месяцев терапии СС в крови больных рРА отмечалось достоверное снижение уровня ИЛ-1β (p < 0,05) (табл. 2). У пациентов, получавших МТ и ЛФ, к концу исследования определялось статистически значимое снижение уровней ИЛ-1β, ИЛ-2 и ИЛ-4 (p < 0,05). Полученные результаты свидетельствуют о том, что терапия МТ и ЛФ у больных рРА оказывает большее влияние на снижение уровней провоспалительных цитокинов и хемокинов по сравнению с СС.
Таблица 2
Динамика уровней цитокинов у больных рРА на фоне лечения сульфасалазином, метотрексатом и лефлуномидом
| Показатели, пг/мл | СС (n = 18) | МТ (n = 18) | ЛФ (n = 16) | Р1–2 | Р3–4 | Р5–6 | Р2–4 | Р2–6 | Р4–6 | |||
| А | Б | А | Б | А | Б | |||||||
| ИЛ-1β | 34,3 ± 3,9 | 11,1 ± 1,3 | 32, 7 ± 4,3 | 17,4 ± 2,5 | 33,0 ± 8,5 | 18,4 ± 4,7 | * | * | * | Н/д | Н/д | Н/д |
| ИЛ-2 | 25,8 ± 15,4 | 21,7 ± 9,4 | 21,0 ± 15,0 | 9,01 ± 3,00 | 26,3 ± 6,8 | 5,07 ± 2,8 | Н/д | * | * | * | * | Н/д |
| ИЛ-4 | 38,8 ± 17,1 | 28,9 ± 37,8 | 42,4 ± 19,1 | 15,7 ± 6,9 | 39,8 ± 24,8 | 15,3 ± 3,8 | Н/д | * | * | * | * | Н/д |
| ИЛ-6 | 38,2 ± 10,1 | 49,6 ± 12,1 | 44,2 ± 10,3 | 31,1 ± 19,8 | 47,7 ± 20,0 | 18,6 ± 12,4 | Н/д | Н/д | * | Н/д | * | * |
| ИЛ-10 | 21,8 ± 5,8 | 24,8 ± 3,5 | 19,4 ± 4,2 | 13,1 ± 0,7 | 21,2 ± 2,7 | 12,4 ± 1,7 | Н/д | Н/д | Н/д | Н/д | Н/д | Н/д |
| ФНО-α | 41,9 ± 9,6 | 28,2 ± 13,2 | 39,4 ± 3,8 | 21,9 ± 2,5 | 46,5 ± 15,7 | 27,0 ± 6,8 | Н/д | Н/д | Н/д | Н/д | Н/д | Н/д |
Примечание: А – исходные значения; Б – значения через 12 месяцев; * – р < 0,05; Н/д – различия статистически недостоверные.
Динамика показателей гуморального звена иммунитета свидетельствовала о достоверном снижении уровня IgG через 12 месяцев терапии СС (p < 0,05). Терапия МТ и ЛФ в течение 12 месяцев привела к достоверному снижению уровней IgG, РФ и ЦИК.
При оценке влияния СС, МТ и ЛФ на показатели рентгенологического прогрессирования в суставах больных рРА было установлено, что через 12 месяцев лечения СС наблюдался достоверный прирост медианы общего счета Шарпа и счета эрозий (p < 0,05), в то время как на фоне терапии МТ и ЛФ динамика показателей рентгенологического прогрессирования была недостоверной (рис. 2).
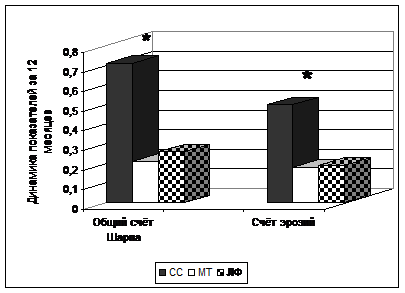
Рисунок 2. Динамика прироста медианы счета Шарпа и счета эрозий (в относительных единицах относительно исходных значений) через 12 месяцев лечения СС, МТ и ЛФ. Примечание: *р < 0,05 – достоверность различий в динамике нарастания медианы общего счета Шарпа и счета эрозий при лечении СС, по сравнению с ЛФ и МТ.
Сравнительная оценка проводимой терапии на втором этапе исследования в группах больных РА, получавших МТ, ИНФ или РМ в комбинации с МТ представлена в таблицах 3 и 4.
Таблица 3
Динамика клинико-иммунологических показателей у больных РА в зависимости от проводимой терапии
| Показатели | Исходно | Через 12 месяцев | ||||
| МТ | ИНФ | РМ | МТ | ИНФ | РМ | |
| 1 | 2 | 4 | 5 | 6 | 8 | 9 |
| DAS28, баллов | 7,00 ± 0,09 | 6,94 ± 0,10 | 6,79 ± 0,09 | 4,65 ± 0,30* | 4,10 ± 0,10* | 2,94 ± 0,10* |
| HAQ, баллов | 2,40 ± 0,05 | 2,62 ± 0,05 | 2,85 ± 0,06 | 1,90 ± 0,09* | 1,70 ± 0,04* | 0,70 ± 0,10* |
| IgA, г/л | 3,20 ± 0,10 | 3,00 ± 0,20 | 3,80 ± 0,10 | 2,80 ± 0,10* | 2,30 ± 0,10* | 2,00 ± 0,10* |
| IgM, г/л | 3,50 ± 0,20 | 3,40 ± 0,08 | 3,40 ± 0,20 | 3,00 ± 0,20* | 1,60 ± 0,20* | 2,80 ± 0,20* |
| IgG, г/л | 18,80 ± 0,30 | 18,70 ± 0,30 | 17,10 ± 0,30 | 18,00 ± 0,30 | 12,20 ± 0,50* | 12,40 ± 0,20* |
| РФU, мл | 147,00 ± 6,70 | 285,70 ± 25,80 | 147,00 ± 2,90 | 138,40 ± 5,90 | 123,40 ± 25,90* | 47,30 ± 5,10* |
| ЦИК, ед. | 176,40 ± 20,30 | 176,30 ± 33,30 | 161,40 ± 17,20 | 183,50 ± 18,00 | 126,80 ± 13,40* | 117,90 ± 14,60* |
Примечание: * – р < 0,05 по сравнению с исходными показателями.
К 12-му месяцу терапии у пациентов всех групп отмечалось снижение показателей активности иммуновоспалительного процесса. В группе больных, находящихся на стандартной базисной терапии МТ, наблюдалось статистически значимое снижение DAS28, HAQ, IgA, IgG, хотя уровни РФ, ЦИК и IgM не отличались от исходных значений. У пациентов, получавших комбинацию ИНФ + МТ, выявлено статистически значимое снижение DAS28, HAQ, IgA, IgG, IgM, РФ, ЦИК (р < 0,05). Назначение РМ + МТ привело к более значимому снижению DAS28, HAQ и РФ, чем в группах, получавших МТ и ИНФ + МТ. Ремиссия наблюдалась у пациентов, получавших МТ, ИНФ + МТ и МТ + РМ в 4, 16 и 24% случаев соответственно. У 4 пациентов, получавших ИНФ в комбинации с МТ, наблюдалось отсутствие ответа на проводимую терапию к 6-му месяцу лечения. В связи с этим мы выявили у этих пациентов высокие титры АТ против химерных анти-ФНО-α антител в сыворотке крови. Титр их составил в среднем 125,8 ± 10,7. При сопоставлении клинических данных (DAS28-СРБ, индекса HAQ, ответа на терапию по критериям ACR) было отмечено, что высокие титры АТ могут способствовать развитию резистентности к проводимому лечению.
Таблица 4
Динамика эрозивного процесса и показателей активности синовита по данным МРТ с контрастным усилением суставов кистей у обследованных больных РА (n/%)
| Показатели | Через 12 месяцев от начала терапии | ||
| МТ (n = 25) | ИНФ + МТ (n = 25) | РМ + МТ (n = 18) | |
| ↑ Эрозий | 11/44% | 15/20%* | 6/33%* |
| ↓Эрозий | 0/0% | 2/8% | 0 |
| Эрозии без динамики | 14/56% | 6/72% | 8/67% |
| ↑ Синовита | 6/24% | 1/4%* | 0/0%* |
| ↓ Синовита | 5/20% | 16/64%* | 5/28% |
| Синовит без динамики | 14/56% | 8/32%* | 13/72% |
Примечание: * – р < 0,05 – относительно показателей группы МТ.
Анализируя данные, представленные в таблице 4, обращает на себя внимание снижение или отсутствие нарастания признаков воспалительной активности синовии во всех группах. Более чем у 44% больных РА, получавших МТ, выявлено прогрессирование остеодеструктивных изменений, что проявилось увеличением количества эрозий. У 72% пациентов, получавших комбинированную терапию ИНФ и МТ, отмечалось отсутствие динамики эрозивного процесса. А у 2 (8%) пациентов этой группы наблюдалось обратное развитие эрозий (рис. 3).
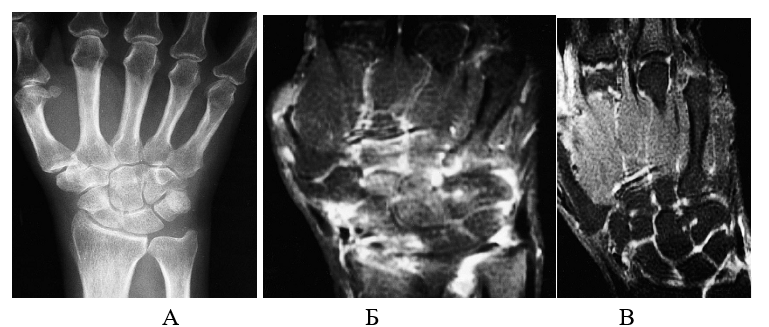
Рисунок 3. Пациентка 46 лет. А – кисть (рентгенограмма), умеренный периартикулярный остеопороз. Б – МРТ Т1 с контрастным усилением, выраженное накопление контрастного вещества с разрастаниями синовия и участками костного мозга. В – МРТ Т1 с контрастным усилением спустя 12 месяцев терапии МТ + ИНФ, значительно меньшая выраженность активности пролиферативных изменений, мелкие сформированные эрозии в зонах прикрепления связок, умеренный теносиновит сухожилия ext. carpi ulnaris.
Отсутствие увеличения количества эрозий через 12 месяцев наблюдения отмечено у 67% пациентов, получавших РТ в комбинации с МТ в качестве первого ГИБП. Положительная клиническая динамика на фоне терапии РМ у 28% больных данной группы ассоциировалась с уменьшением признаков синовита (рис. 4).
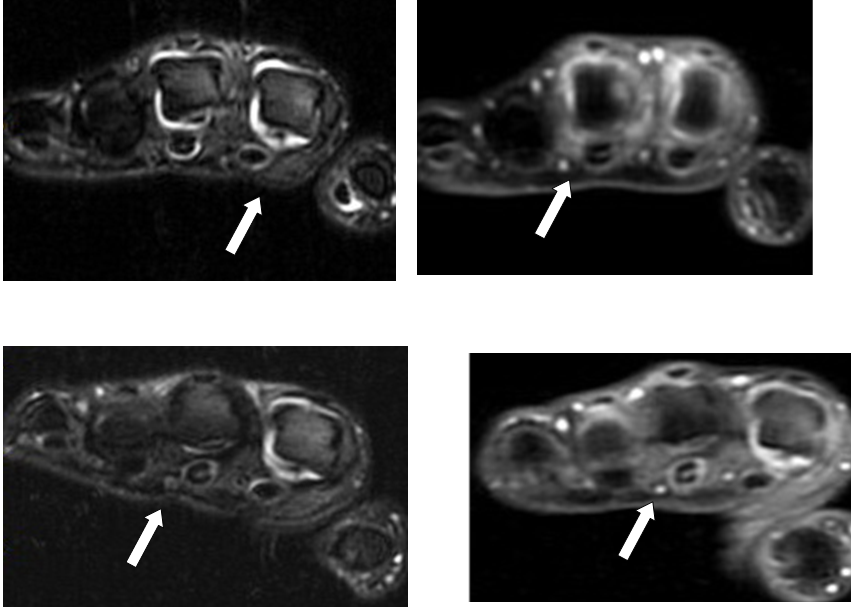
Рисунок. 4. Пациентка Д., 39 лет, МРТ Т2 ВИ FAT SAT, аксиальная плоскость, МРТ Т1 ВИ FAT SAT + C, аксиальная плоскость. Верхний ряд – на момент начала терапии ритуксимабом и метотрексатом: патологический выпот в полости II–III пястно-фаланоговых суставов, накопление контрастного препарата утолщенной синовией II–III пястно-фаланговых суставов. Нижний ряд – в динамике спустя 12 месяцев. Сохраняется умеренное количество патологического выпота в полости и избирательное накопление контрастного препарата утолщенной синовиальной оболочкой II пястно-фалангового сустава.
В таблице 5 представлены показатели качества жизни больных РА по значениям шкалы SF-36 исходно и через 12 месяцев лечения МТ, МТ + ИНФ или МТ + РМ.
Таблица 5
Показатели качества жизни по шкале SF-36, у больных РА, получавших терапию МТ, ИНФ + МТ или РМ + МТ (М ± SD)
| Показатели качества жизни | МТ (n = 25) | ИНФ + МТ (n = 25) | РМ + МТ (n = 51) | |||
| Исходно | Через 12 месяцев | Исходно | Через 12 месяцев | Исходно | Через 12 месяцев | |
| PF | 32,22 ± 8,12 | 33,19 ± 7,97 | 30,14 ± 6,81 | 36,24 ± 1,61* | 34,24 ± 1,92 | 39,21 ± 2,09* |
| RP | 39,62 ± 5,53 | 41,34 ± 8,90 | 35,12 ± 5,14 | 44,13 ± 6,44 | 38,92 ± 2,54 | 43,17 ± 4,14 |
| BP | 39,23 ± 7,12 | 43,67 ± 9,45 | 40,65 ± 6,12 | 47,55 ± 5,92 | 37,85 ± 8,37 | 44,51 ± 3,13 |
| GH | 38,84 ± 6,23 | 42,45 ± 5,91 | 39,43 ± 7,34 | 43,40 ± 7,74 | 36,87 ± 5,24 | 40,26 ± 5,43 |
| VT | 42,33 ± 6,98 | 41,56 ± 2,65 | 37,35 ± 7,64 | 44,37 ± 7,84* | 40,14 ± 9,59 | 45,17 ± 3,27 * |
| SF | 42,83 ± 8,87 | 47,92 ± 7,65 | 36,76 ± 8,12 | 46,45 ± 9,23 | 39,16 ± 1,18 | 40,45 ± 1,13 |
| RE | 41,78 ± 9,13 | 41,83 ± 1,34 | 40,17 ± 7,32 | 43,61 ± 1,62* | 40,97 ± 9,02 | 44,23 ± 0,02* |
| MH | 41,68 ± 8,12 | 42,65 ± 3,78 | 40,71 ± 7,89 | 41,91 ± 8,98 | 41,17 ± 8,68 | 43,18 ± 6,45 |
Примечание: PF – физическое функционирование; RP – ролевое физическое функционирование; BP – соматическая боль; GH – общее состояние здоровья; VT – жизнеспособность, SF – социальное функционирование; RE – ролевое эмоциональное функционирование; MH – психическое здоровье. * – р < 0,05– достоверность различий относительно соответствующих значений в подгруппе МТ.
Через 12 месяцев лечения в подгруппах больных, получавших ИНФ + МТ или РМ + МТ, по сравнению с показателями в подгруппе МТ, отмечались достоверно более высокие значения физического функционирования, жизнеспособности и ролевого эмоционального функционирования (р < 0,05). Достоверных различий в показателях КЖ у больных, получавших различные схемы ГИБТ, не получено. Нами отмечено, что разница суммарных шкал общего опросника оценки качества жизни SF-36 физического и психологического здоровья в группе больных, получавших РМ после неэффективности или непереносимости ИНФ, соответствовала 14,8 и 18,2 балла, а в группе пациентов, которым РМ был назначен в качестве первого ГИБП, эти показатели оказались выше – 17,23 и 20,90 балла соответственно. В группе больных, получавших МТ, отмечена менее выраженная положительная динамика (разница показателей 8,98 и 6,83 балла соответственно).
Представлялось важным сравнить показатели стрессоустойчивости по опроснику Холмса у больных РА через 24 недели терапии МТ (подгруппа 1) и МТ + ИНФ (подгруппа 2), данные представлены на рисунке 5. В группе больных РА, получавших МТ + ИНФ, через 24 недели терапии отмечено большее число пациентов, имевших высокую стрессоустойчивость, по сравнению с больными РА, получавшими МТ (38,7 и 27,9%; p < 0,05) (рис. 5).
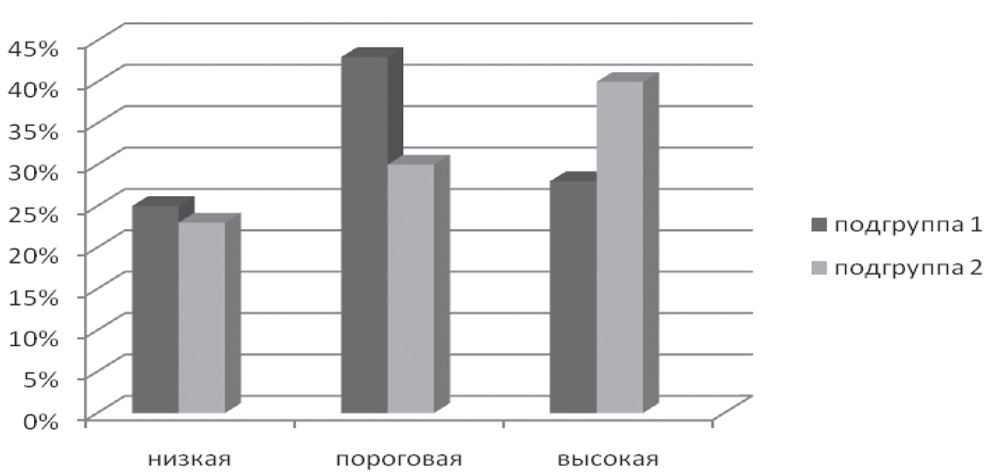
Рисунок 5. Показатели стрессоустойчивости по опроснику Холмса через 24 недели терапии МТ или МТ + ИНФ.
При оценке нежелательных явлений на фоне проводимых схем лечения чаще наблюдались инфекции мочевыводящих путей у пациентов, получавших РМ + МТ (23%), и реже при назначении МТ и ИНФ + МТ (12 и 16%). Герпес-вирусная инфекция отмечалась с невысокой частотой в группах МТ, ИНФ + МТ и РМ + МТ и развивалась у 4, 13 и 10% соответственно). Данные побочные эффекты носили умеренно выраженный характер и требовали временной отмены препарата. У одного пациента развился синдром лекарственной системной красной волчанки (с появлением антител к двуспиральной ДНК), претерпевшей обратное развитие после отмены ИНФ. Побочных реакций, угрожавших жизни пациентов, ни в одной группе отмечено не было.
При анализе полученных данных на третьем этапе наблюдения выявлено достоверное снижение активности РА по индексу DAS28-CРБ уже к 24-й неделе лечения тоцилизумабом (табл. 6) Эта динамика была высокодостоверна (p < 0,01) по сравнению с исходными параметрами.
Таблица 6
Динамика HAQ, СРБ и DAS28-СРБ у больных РА через 24 недели лечения тоцилизумабом
| Исходно | 24 недели | |
| HAQ, баллов | 1,54 ± 0,47 | 1,05 ± 0,3 * |
| СРБ, мг/л | 29,51 ± 13,2 | 19,5 ± 13,4* |
| DAS28-СРБ, баллов | 5,24 ± 1,0 | 3,7 ± 1,1* |
Примечание: * – p < 0,01 – различия относительно исходных параметров.
Применение различных линий ГИБТ у пациентов с РА в реальной практике демонстрирует следующий клинический случай.
Пациентка Р., 50 лет, больна в течение 27 лет. В качестве базисной терапии получала метотрексат 15 мг в неделю., неоднократно вводился внутримышечно дипроспан в связи с синовитами. Отмена метотрексата через 2 года из-за диспептических явлений с переводом на сульфасалазин 3 г в сутки, который был отменен через год из-за отсутствия эффекта. Неоднократно проводилась пульс-терапия (солумедрол 500 мг № 3) с непродолжительным эффектом, назначена базисная терапия в варианте лефлуномида 20 мг в сутки. Учитывая низкую эффективность предшествующей терапии, выполнено последовательно 12 подкожных введений адалимумаба 0,8 мл – 40 мг, 13 инфузий инфликсимаба (ремикейд 3 мг/кг) со слабым положительным эффектом (суставной синдром сохранялся), в связи с чем сроки между инфузиями были сокращены до 4 недель. В дальнейшем выполнено четыре инфузии ритуксимаба по 500 мг с незначительным положительным эффектом (уменьшение суставного синдрома и утренней скованности). С апреля 2014 года пациентка получает монотерапию тоцилизумабом (лефлуномид отменен из-за развития лекарственного стоматита). На фоне проводимой терапии тоцилизумабом раз в 4 недели отметила положительную динамику (уменьшение суставного синдрома и утренней скованности). Через 6 месяцев терапии разрывы между введениями препарата составили раз в 6 недель. Лечение продолжает. Динамика активности РА по индексу DAS28-CРБ на фоне терапии тоцилизумабом у пациентки в период наблюдения представлена на рисунке 6.
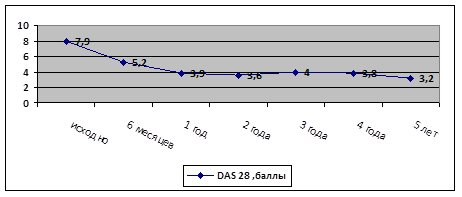
Рисунок 6. Динамика активности РА по индексу DAS28-CРБ на фоне терапии тоцилизумабом у пациентки Р.
Заключение
Таким образом, выбор оптимальной тактики лечения пациентов с РА даже при наличии международных рекомендаций является сложной задачей. Результаты нашего сравнительного исследования подтвердили преимущество ранней цитостатической терапии перед применением ступенчатой схемы лечения с использованием на первых этапах СС в качестве первого базисного препарата для лечения больных рРА. Наблюдение за больными с активным течением рРА в течение 12 месяцев свидетельствует о том, что комбинированная терапия ИНФ и МТ или РМ и МТ имеет очевидные преимущества перед монотерапией МТ при отсутствии достижения ремиссии или низкой активности от его применения в дозе не менее 20 мг в неделю через 6 месяцев терапии и ведет к значимому снижению клинико-иммунологической активности заболевания, улучшению показателей качества жизни пациентов и замедлению темпов суставной деструкции. У пациентов, получавших ИНФ и МТ, ремиссия РА наблюдалась у 16% больных, а в группе обследованных, которым проводилась терапия РМ и МТ, – у 24% пациентов. В группе больных, получавших МТ, ремиссия РА наблюдалась только у 4% обследованных. Обращает внимание тот факт, что между группами больных, получавших биологическую терапию ИНФ и РМ, не выявлено статистически значимых различий в динамике лабораторных маркеров активности болезни (СРБ, СОЭ, ЦИК) и показателей рентгенологического прогрессирования, что подтверждает возможность «переключения» терапии с первого ГИБП на препараты последующих линий при нарастании клинической активности РА. Важным положением является тот факт, что у части больных, получавших инфликсимаб и метотрексат, к 9-му месяцу терапии наблюдался феномен ускользания лечебного эффекта. Возможный механизм резистентности к проводимому лечению, по-видимому, был связан с формированием антител к данному препарату [7], что является показанием к отмене инфликсимаба и назначению других генно-инженерных биологических препаратов. Применение тоцилизумаба у больных РА способствовало достоверному снижению активности РА по индексу DAS28-CРБ уже к 24-й неделе лечения и сохранению положительной динамики в течение длительного периода независимо от линии назначения применяемой терапии и использования БПВП. Следовательно, тоцилизумаб может быть препаратом второй и третьей линии при ускользании эффекта от других ГИБП.
Список литературы / References
- Насонов Е.Л., Каратеев Д.Е., Балабанова Р.М. Ревматоидный артрит. В кн.: «Ревматология. Национальное руководство» под ред. Е.Л. Насонова, В.А. Насоновой. М.: ГЭОТАР-Медиа, 2008. С. 290–331.
Nasonov E.L., Karateev D.E., Balabanova R.M. Rheumatoid arthritis. In the book: Rheumatology. National Leadership, ed. E.L. Nasonova, V.A. Nasonova. M.: GEOTAR-Media, 2008. P. 290–331. - Насонов Е.Л. Фармакотерапия ревматоидного артрита – взгляд в 21 век. Клин мед. 2005. № 6. С. 8–12.
Nasonov E.L. Pharmacotherapy of rheumatoid arthritis – a look into the 21st century. Clin. Med. 2005. No. 6. P. 8–12. - Насонов Е.Л., Каратеев Д.Е., Чичасова Н.В. Новые рекомендации по лечению ревматоидного артрита (EULAR, 2013): место метотрексата. Научно-практическая ревматология. 2014; 52 (1): 8–26. https://doi.org/10.14412/1995-4484-2014-8-26
Nasonov E.L., Karateev D.E., Chichasova N.V. New guidelines for the treatment of rheumatoid arthritis (EULAR, 2013): the place of methotrexate. Scientific and Practical Rheumatology. 2014; 52 (1): 8–26. https://doi.org/10.14412/1995-4484-2014-8-26 - Насонов Е.Л., Каратеев Д.Е., Чичасова Н.В. Рекомендации EULAR по лечению ревматоидного артрита – 2013: общая характеристика и дискуссионные проблемы. Научно-практическая ревматология. 2013; 51 (6): 609–22. https://doi.org/10.14412/1995-4484-2013-609-22
Nasonov E.L., Karateev D.E., Chichasova N.V. EULAR guidelines for the treatment of rheumatoid arthritis – 2013: General characteristics and controversial issues. Scientific and practical rheumatology. 2013; 51 (6): 609–22. https://doi.org/10.14412/1995-4484-2013-609-22 - Мазуров В.И. Клиническая ревматология. Руководство для врачей. М.: Е-ното, 2021. С. 93–101.
Mazurov V.I. Clinical rheumatology. Guide for Doctors. Moscow: E-noto, 2021, pp. 93–101. - Беляева И.Б., Мазуров В.И. Сравнительная оценка лечебного эффекта сульфасалазина, метотрексата и лефлуномида при раннем ревматоидном артрите. Вестник Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова. 2006; № 3. С. 129–132.
Belyaeva I.B., Mazurov V.I. Comparative evaluation of the therapeutic effect of sulfasalazine, methotrexate and leflunomide in early rheumatoid arthritis. Bulletin of the St. Petersburg State Medical Academy n.a. I.I. Mechnikov. 2006; No. 3, pp. 129–132. - Беляева И.Б. Ранний ревматоидный артрит. Современные возможности диагностики и лечения. И.Б. Беляева, В.И. Мазуров, Т.Н. Трофимова, Е.А. Трофимов. СПб: Изд. Медфорум, 2018. 138 с.
Belyaeva I.B. Early rheumatoid arthritis. Modern possibilities of diagnostics and treatment. I.B. Belyaeva, V.I. Mazurov, T.N. Trofimova, E.A. Trofimov. St. Petersburg: Ed. Medforum, 2018. 138 p. - Авлохова С.Р., Мазуров В.И. Зависимость показателей качества жизни больных ревматоидным артритом от длительности заболевания. Материалы XIII Северо-Западной научно-практической конференции по ревматологии. СПб.: Изд-во «Человек и здоровье», 2013. С. 3.
Avlokhova S.R., Mazurov V.I. Dependence of indicators of the quality of life of patients with rheumatoid arthritis on the duration of the disease. Proceedings of the XIII North-Western Scientific and Practical Conference on Rheumatology. St. Petersburg: Publishing House ‘Man and Health’, 2013. P. 3. - Жугрова Е.С. Мазуров В.И., Рассохин В.В., Завьялкина Е.В. Применение инфликсимаба (Ремикейд) у больных ревматоидным артритом. Вестник Санкт-Петербургского университета. 2007. Вып. 3. Сер. 11. С. 50–55.
Zhugrova E.S. Mazurov V.I., Rassokhin V.V., Zavyalkina E.V. The use of infliximab (Remicade) in patients with rheumatoid arthritis. Bulletin of St. Petersburg University. 2007. Issue 3. Ser. 11. P. 50–55. - van Vollenhoven RF. Treatment of rheumatoid arthritis: state of the art 2009. Nat Rev Rheumatol. 2009 Oct; 5 (10): 531–41. https://doi.org/10.1038/nrrheum.2009.182
- Arnett FC, Edworthy SM, Bloch DA, et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum. 1988 Mar; 31 (3): 315–24. https://doi.org/10.1002/art.1780310302
- Октябрьская И.В, Беляева И.Б. Влияние средств базисной и биологической терапии на показатели клинической активности, качество жизни и психологический статус больных ранним ревматоидным артритом. Фарматека. 2011; № 9. С. 75–77.
Oktyabrskaya I.V., Belyaeva I.B. Influence of basic and biological therapy on indicators of clinical activity, quality of life and psychological status of patients with early rheumatoid arthritis. Pharmateka. 2011; No. 9, pp. 75–77.
Мазуров Вадим Иванович, д.м.н., проф., акад. РАН, заслуженный деятель науки РФ, гл. научный консультант, директор НИИ ревматологии, зав. кафедрой терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда1, рук. центра аутоиммунных заболеваний2. SPIN: 6823-5482. Researcher ID: A-8944-2016. Scopus ID: 16936315400. ORCID: 0000-0002-0797-2051
Беляева Ирина Борисовна, д.м.н., проф. кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда1. E-mail: belib@mail.ru. SPIN 3136-9062. ORCID: 0000-0002-7981-6349
Трофимов Евгений Александрович, д.м.н., проф. кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда1. SPIN: 4358-1663. ORCID: 0000-0003-3236-4485
Октябрьская Ирина Валентиновна, врач-ревматолог2.
Самигуллина Рузана Рамиловна, ассистент кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда1. ORCID: 0000-0002-6341-3334
Чудинов Антон Леонидович, к.м.н., зав. отделением (с кабинетом терапии ГИБТ)2. SPIN: 5771-8320. ORCID: 0000-0002-7675-5683
Инамова Оксана Владимировна, к.м.н., ассистент кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда1, гл. врач2. SPIN: 8841-5496. ORCID: 0000-0001-9126-3639
1ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И.И. Мечникова» Минздрава России, Санкт-Петербург
2СПб ГБУЗ «Клиническая ревматологическая больница № 25», Санкт-Петербург
Автор для переписки: Беляева Ирина Борисовна. E-mail: belib@mail.ru
Mazurov Vadim I., DM Sci (habil.), professor, academician of RAS, honored worker of science of the Russian Federation, chief scientific consultant, director of the Research Institute of Rheumatology, head of Dept of Therapy, Rheumatology, Examination of Temporary Disability and Quality of Medical Care n.a. E.E. Eichwald1, head of Centre for autoimmune diseases. SPIN: 6823-5482. Researcher ID: A-8944-2016. Scopus ID: 16936315400. ORCID: 0000-0002-0797-2051
Belyaeva Irina B., DM Sci (habil.), professor at Dept of Therapy, Rheumatology, Examination of Temporary Disability and Quality of Medical Care n.a. E.E. Eichwald1. E-mail: belib@mail.ru. SPIN 3136-9062. ORCID: 0000-0002-7981-6349
Trofimov Evgeni А., DM Sci (habil.), professor at Dept of Therapy, Rheumatology, Examination of Temporary Disability and Quality of Medical Care n.a. E.E. Eichwald1. SPIN: 4358-1663. ORCID: 0000-0003-3236-4485
Oktyabrskaya Irina V., rheumatologist2. E-mail: oktirina@mail.ru
Samigullina Ruzana R., assistant at Dept of Therapy, Rheumatology, Examination of Temporary Disability and Quality of Medical Care n.a. E.E. Eichwald1. ORCID: 0000-0002-6341-3334
Chudinov Anton L., PhD Med, head of Centre for Biologic Therapies2. SPIN: 5771-8320. ORCID: 0000-0002-7675-5683
Inamova Oksana V., PhD Med, assistant at Dept of Therapy, Rheumatology, Examination of Temporary Disability and Quality of Medical Care n.a. E.E. Eichwald1, chief physician2. SPIN: 8841-5496. ORCID: 0000-0001-9126-3639
1North-West State Medical University n.a. I.I. Mechnikov, Saint-Petersburg, Russia
2Clinical Rheumatology Hospital No. 25, Saint-Petersburg, Russia
Corresponding author: Belyaeva Irina B. E-mail: belib@mail.ru
Для цитирования: Мазуров В.И., Беляева И.Б., Трофимов Е.А., Октябрьская И.В.,
Самигуллина Р.Р., Чудинов, А.Л. Инамова О.В. Сравнительная оценка влияния
различных средств базисной и генно-инженерной биологической терапии на клиническое течение, скорость развития остеодеструктивных изменений, качество
жизни и состояние стрессоустойчивости больных ревматоидным артритом (открытое наблюдательное исследование). Медицинский алфавит. 2022; (29): 28–35.
https://doi. org/10.33667/2078-5631-2022-29-28-35.
For citation: Mazurov V.I., Belyaeva I.B., Trofmov Е.А., Oktyabrskaya I.V., Samigullina R.R., Chudinov A.L., Inamova O.V. Comparative evaluation of effect of various
means of basic and genetically engineered biological therapy on clinical course,
rate of development of osteodestructive changes, quality of life and state of stress
resistance in patients with rheumatoid arthritis (open observational study). Medical
alphabet. 2022; (29): 28–35. https://doi.org/10.33667/2078-5631-2022-29-28-35.

