Митина Л.А., Степанов С.О., Ратушная В.В., Долгачева Д.В., Соловьев В.А., Малекин К.А.
Статья из журнала «Медицинский алфавит» серия «Диагностика и онкотерапия» (4), 2022
The use of contrast-enhanced ultrasound in the evaluating of the effectiveness of kidney tumor ablation
Московского научно-исследовательского онкологического института имени П.А. Герцена – филиала ФГБУ “Национальный медицинский исследовательский центр радиологии” Министерства здравоохранения Российской Федерации (г. Москва)
Mitina L.A., Stepanov S.O., Ratushnaya V.V., Dolgacheva D.V., Soloviev V.A., Malekin K.A
National Medical Research Radiological Center, Moscow
Сведения об авторах:
Митина Лариса Анатольевна – д.м.н., ведущий научный сотрудник отделения ультразвуковой диагностики Московского научно-исследовательского онкологического института имени П.А. Герцена – филиала ФГБУ “Национальный медицинский исследовательский центр радиологии” Министерства здравоохранения Российской Федерации, г. Москва. E—mail: lmitina@list.ru. ORCID 0000-0002-3563-7293.
Степанов Станислав Олегович — заведующий отделением ультразвуковой диагностики Московского научно-исследовательского онкологического института имени П.А. Герцена – филиала ФГБУ “Национальный медицинский исследовательский центр радиологии” Министерства здравоохранения Российской Федерации, г. Москва. ORCID 0000-0001-5025-3378
Ратушная Виктория Валерьевна — врач отделения ультразвуковой диагностики Московского научно-исследовательского онкологического института имени П.А. Герцена – филиала ФГБУ “Национальный медицинский исследовательский центр радиологии” Министерства здравоохранения Российской Федерации, г. Москва
Долгачева Дарья Вячеславовна — младший научный сотрудник отделения ультразвуковой диагностики Московского научно-исследовательского онкологического института имени П.А. Герцена – филиала ФГБУ “Национальный медицинский исследовательский центр радиологии” Министерства здравоохранения Российской Федерации, г. Москва
Соловьев Василий Александрович — младший научный сотрудник отделения ультразвуковой диагностики Московского научно-исследовательского онкологического института имени П.А. Герцена – филиала ФГБУ “Национальный медицинский исследовательский центр радиологии” Министерства здравоохранения Российской Федерации, г. Москва. E—mail: sovasilij@yandex.ru
Малекин Кирилл Александрович — врач отделения ультразвуковой диагностики Московского научно-исследовательского онкологического института имени П.А. Герцена – филиала ФГБУ “Национальный медицинский исследовательский центр радиологии” Министерства здравоохранения Российской Федерации, г. Москва.
Author information:
Mitina Larisa Anatolyevna – M.D., Ph.D., Leading Researcher, Ultrasound Diagnostics Department, National Medical Research Radiological Center, Moscow, Russian Federation. E-mail: lmitina@list.ru. ORCID 0000-0002-3563-7293.
Stepanov Stanislav Olegovich – the Head of the Department of Ultrasound Diagnostics, National Medical Research Radiological Center, Moscow, Russian Federation. ORCID 0000-0001-5025-3378
Ratushnaya Victoria Valerievna – the Doctor of Ultrasound Diagnostics Department, National Medical Research Radiological Center, Moscow, Russian Federation.
Dolgacheva Daria Vyacheslavovna — junior scientist of Department of Ultrasound Diagnostics, National Medical Research Radiological Center, Moscow, Russian Federation.
Solovyov Vasily Alexandrovich — junior scientist of Department of Ultrasound Diagnostics, National Medical Research Radiological Center, Moscow, Russian Federation. E-mail: sovasilij@yandex.ru
Malekin Kirill Alexandrovich — the Doctor of Ultrasound Diagnostics Department, National Medical Research Radiological Center, Moscow, Russian Federation.
Аннотация.
Актуальность. Статья посвящена ультразвуковому исследованию с контрастным усилением у пациентов на разных этапах малоинвазивного (радиочастотной абляции — РЧА) лечения опухоли почки.
Цель. Повысить эффективность малоинвазивного лечения злокачественных опухолей почек с применением контрастного препарата при ультразвуковом исследовании.
Материалы и методы. В группу вошли 32 (100%) пациента со злокачественными опухолями почек, которым отказано в хирургическом лечении в связи с наличием тяжёлой сопутствующей соматической патологии или наличием одной почки. У 3-х пациентов наблюдалась аллергическая реакция на контраст, применяемый в КТ и МРТ, поэтому динамическое наблюдение проводилось только на основании данных, полученных при контраст-усиленном ультразвуковом исследовании (КУУЗИ). Всем пациентам до проведения РЧА и на всех этапах динамического контроля проводилось ультразвуковое исследование с контрастным усилением. У 29 пациентов результаты через 1 месяц после абляции сравнивались с МРТ или КТ с контрастированием.
Выводы. Работа показала, что ультразвуковое исследование почек с контрастным усилением может эффективно проводить оценку эффективности выполнения РЧА злокачественных образований почек у пациентов, которым было отказано в выполнении хирургического лечения.
Abstract
Relevance. The article is devoted to contrast-enhanced ultrasound in patients at different stages of minimally invasive (radiofrequency ablation — RFA) treatment of a kidney tumor.
Objective. To increase the effectiveness of minimally invasive treatment of malignant tumors of the kidneys with the use of a contrast agent in ultrasound examination.
Materials and methods. The group included 32 (100%) patients with malignant tumors of the kidneys who were denied surgical treatment due to the presence of severe concomitant somatic pathology or the presence of one kidney. In 3 patients, an allergic reaction to the contrast used in CT and MRI was observed, therefore, dynamic observation was carried out only on the basis of data obtained during CEUS. Before RFA and at all stages of dynamic control, all patients underwent contrast-enhanced ultrasound examination. In 29 patients, results one month after ablation were compared with contrast-enhanced MRI or CT.
Conclusions. The work showed that contrast-enhanced renal ultrasound can effectively evaluate the effectiveness of RFA of kidney malignancies in patients who were denied surgical treatment.
Ссылка на данный источник обязательна: https://www.mnioi.nmicr.ru/
Актуальность.
Несмотря на успешное лечение и проводимую раннюю диагностику, рак почки занимает 2-е место среди новообразований мочеполовой системы с тенденцией к росту заболеваемости. Сегодня мы располагаем современными и качественными методами лучевой и функциональной диагностики. Сюда входят: компьютерная томография (КТ), магнитно – резонансная томография (МРТ), позитронно – эмиссионная компьютерная томография (ПЭТ-КТ), ультразвуковое исследование (УЗИ) [1,2].
Возможности ультразвуковой диагностики не стоят на месте. В настоящее время контрастные препараты стали внедряться и использоваться в УЗ-диагностике. Это был большой прорыв в качестве, как ранней диагностики, так и в контроле после проведенного лечения. Преимуществом в лечении остаётся за хирургическим вмешательством, но объем и тактика этого вмешательства будет напрямую зависеть от полученных диагностических данных. Чаще всего раком почки страдают люди в возрасте от 60 до 75 лет. Как правило, основная масса этих пациентов имеет в наличии ряд хронических заболеваний, которые, как правило, тоже оказывают влияние на выбор тактики лечения [1,2,3].
Радиочастотная абляция (РЧА) опухоли почки, в большей степени, предназначена для пациентов, чьё состояние отягощено сопутствующими заболеваниями, наличием контрлатерального рецидива или других причин. РЧА используют для лечения малых опухолей почек, но размеры применяемые к слову «малые», везде различные. В странах запада к малым опухолям почек относят образования, не превышающие 4 см, в нашей стране эта цифра не более 2-2,5 см для оптимально проведенной процедуры [3,4]. Как утверждает Regier M и соавт. (1995) первичный успех этих манипуляций колеблется от 88% до 100%. Более 95% опухолей диаметром менее 3 см могут подвергнуться полной деструкции. По современным данным 5-летняя безметастатическая выживаемость пациентов приблизительна 88 – 99%. Самое основное преимущество у этих методик лечения в том, что в большей степени они не ухудшают функции почки и рекомендованы, как основной вариант лечения у больных с нарушением функции второй почки (или ее отсутствием) [2,4,5]. РЧА опухоли почки может проводиться в условиях стационара одного дня. Методика заключается в следующем: в опухоль черескожно под контролем ультразвукового исследования вводят зонд, после этого, через этот зонд направляется тепловая энергия с помощью высокочастотного переменного тока, который выпускается из электрода на кончике зонда. Далее со временем образуется коагуляционный некроз и клеточная гибель, после того, как температура превысит 48-50 °С. Размер зоны некроза будет напрямую зависеть от времени обработки и температуры. Хочется отметить, что у отдалённых зон опухоли от источника переменного тока есть риск остаться неповрежденными, что чаще происходит в опухолях более 2 см. Некоторые авторы рекомендуют использовать второй зонд, или после успешной процедуры переставить первый зонд. Перед проведение РЧА необходимо уточнить диагноз для чего перед проведением малоинвазивного лечения выполняется пункционная биопсия опухоли почки с морфологическим исследованием полученного материала. T.M. Wah со своими коллегами доказал эффективность проведения РЧА вместо хирургической операции на 200 пациентах. Контроль этими авторами осуществлялся с помощью КТ и МРТ. Ответ на данное лечение определялся отсутствием накопления контрастного препарата в зоне проведения РЧА. Средний размер опухоли в их работе составил 2,9 см диапазоном от 1 до 5,6 см. Возраст 67,7, а диапазон от 21 до 88,6 лет, выживаемость составила 46,1 месяцев. Основной уровень успеха составил приблизительно от 95,5% до 98,5%. Поведение контроля за зоной абляции необходимо для своевременного выявления рецидива или диагностики остаточной ткани, не подвергшейся абляции.
Применение контрастного препарата в ультразвуковой диагностике, как опухоли почки, так и контроля за качеством проведённого лечения, является актуальным и перспективным в лечении больных с маленькими опухолями почки, особенно, в случаях невозможности проведения хирургического лечения [4,5,6].
Цель исследования. Повысить эффективность малоинвазивного лечения злокачественных опухолей почек с применением контрастного препарата при ультразвуковом исследовании.
Материалы и методы.
В группу для РЧА вошли 32 (100%) пациента со злокачественными опухолями почек, которым отказано в хирургическом лечении в связи с наличием тяжёлой сопутствующей соматической патологии или наличием одной почки. У 3-х пациентов наблюдалась аллергическая реакция на контрастный препарат, применяемый в КТ и МРТ, поэтому динамическое наблюдение проводилось только на основании данных полученных при КУУЗИ. В группе: 11 (34,38%) мужчин и 21 (65,62%) женщина. Медиана возраста пациентов составила 64,0 года, среднее значение – 64,0 ± 5,1 года (здесь и далее M ± σ), минимальное – максимальное значения – 54,0–75,0 года. Медиана размера опухолевых образований пациентов составила 26,0 мм, среднее значение – 26,0 ± 7,5 мм (здесь и далее M ± σ), минимальное – максимальное значения – 10,0–51,0 мм.
РЧА выполнялось на системе радиочастотной абляции COOL-TIP производитель Medtronic (Covidien) использовалась игла длинной 15-20 см, диметром 17 G, а также аппарат для радиочастотной абляции Rita 1500X производитель AngioDynamics с иглой Rita Starburst XL, длина иглы подбиралась индивидуально (страна – производитель США). Во время процедуры к опухоли подводили зонд под контролем УЗ — исследования и вводили в центр опухоли. Далее через этот зонд подавали тепловую энергию с помощью высокочастотного переменного тока, который выпускается из электрода на кончике зонда. Термическое повреждение приводило к коагуляционному некрозу и клеточной смерти, после того, как температура превысит 50 °С. Размер зоны некроза будет напрямую зависеть от времени обработки и температуры. В зависимости от размера очага временной интервал выбирается индивидуально, но, как правило, не менее 12-15 мин. После проведения процедуры абляции проводился контрольный осмотр УЗИ с контрастированием зоны некроза.
Ультразвуковое исследование почек выполнялось на аппарате Epiq 7 (Philips, Нидерланды) с использованием широкополосного абдоминального конвексного датчика с частотой 3,5–5 МГц. Проводили стандартное исследование забрюшинного пространства в В-режиме и допплерографических режимах с оценкой расположения и размеров опухоли и почки, распространения опухоли на окружающие ткани, подвижности почки, наличия или отсутствия тромбов в почечной вене, а также других дополнительных образований и др. Размеры почек, размеры и структуру опухоли в В-режиме вносились в таблицы для дальнейшего сравнения с контрастным исследованием и для дальнейшего динамического наблюдения.
Далее проводилось КУУЗИ почек с использованием ультразвукового контрастного препарата Соновью (Bracco Swiss S.A., Швейцария) (2,5 мл на одного пациента) и программного обеспечения QLAB (Philips, Нидерланды). Во время КУУЗИ пациент укладывается на кушетку в зависимости от стороны исследования, успокаивается, уменьшает глубину дыхательных движений передней брюшной стенки. Сначала пациента осматривали в В-режиме для выбора наиболее оптимальной проекции образования (необходимо оптимальное расположение датчика над зоной, где расположены опухоль и паренхима почки (для сравнительной оценки), с чёткой визуализацией области интереса). Пациенту вводили 5 мл 0,9%-го раствора NaCl для проверки проходимости катетера. После чего вводили 2,5 мл контрастного препарата Соновью. Сразу после введения дополнительно вводилось 5 мл 0,9%-го раствора NaCl. Одновременно с введением ультразвукового контрастного препарата включалась запись кинопетли и начинался отсчёт времени на УЗ-аппарате. Принимая во внимание, что почки — самый подвижный орган при дыхании, для получения наиболее точных качественных и количественных показателей пациентов просили задержать дыхание на кортикальной фазе от начала исследования (время появления контрастного препарата в корковом веществе почки) и во время начала вымывания контрастного препарата из почки.
Статистическую обработку результатов проводили с помощью пакета прикладных программ MedCalc (версия 15.8) в среде Windows. Полученные качественные переменные представлены абсолютными и относительными частотами, количественные – в виде медианы, M ± σ (среднее значение ± стандартное отклонение), 25–75-го процентилей, 5–95-го процентилей, минимального – максимального значений. Сравнение качественных признаков проводили с помощью критерия χ2 и точного критерия Фишера, количественных – по критерию Манна–Уитни. Результаты считали достоверными при р<0,05. Проводились корреляционный анализ (с расчетом коэффициента ранговой корреляции Спирмена (rS)) и ROC-анализ (с представлением ROC кривых и стандартных показателей информативности). Для оценки степени корреляции использовалась шкала Чеддока (Сhaddock scale). Слабой корреляции соответствовали значения rS от 0,100 до 0,300, умеренной – 0,300–0,500, заметной – 0,500–0,700, высокой – 0,700–0,900, весьма высокой – 0,900–1,000. Достоверными считали корреляции при р<0,05.
Результаты
Размеры опухолей составили от 10 мм до 51 мм. Гистологическое заключение в группе пациентов с малоинвазивным вмешательством: светлоклеточная карцинома G1 – n=12, светлоклеточная карцинома G2 – n=19, онкоцитома – n=1
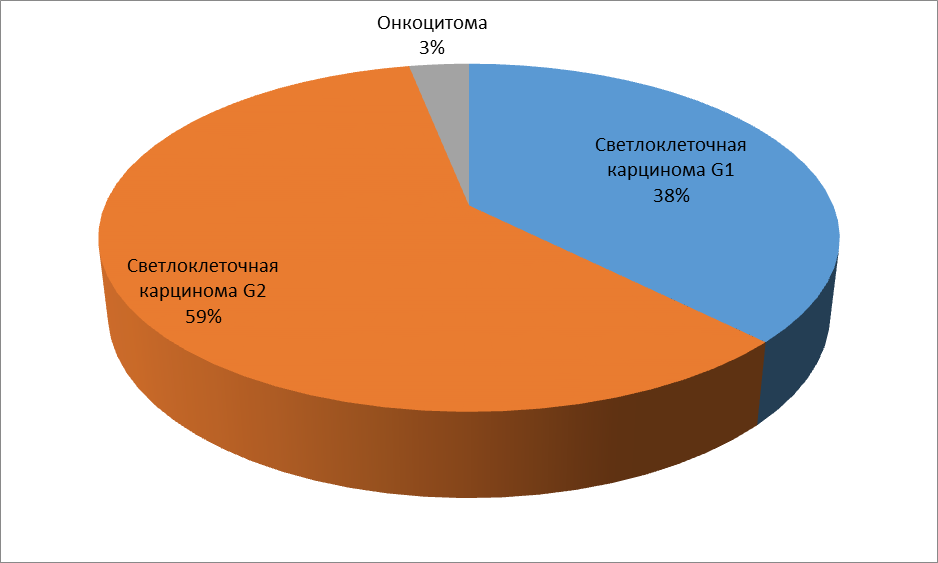
Рисунок 1. Распределение пациентов, которым выполнено КУУЗИ до и после проведения РЧА.
Для дальнейшего динамического контроля всем пациентам было выполнено КУУЗИ через 1,3, 6 и 12 месяцев после РЧА опухоли. У n=7 (21,9%) пациентов выявлена остаточная зона, непосредственно, после проведённой РЧА. У n=2 из 7 остаточная зона выявлена через 3 месяца после проведения РЧА. Оценивались зоны абляции в В – режиме и при контрастировании.
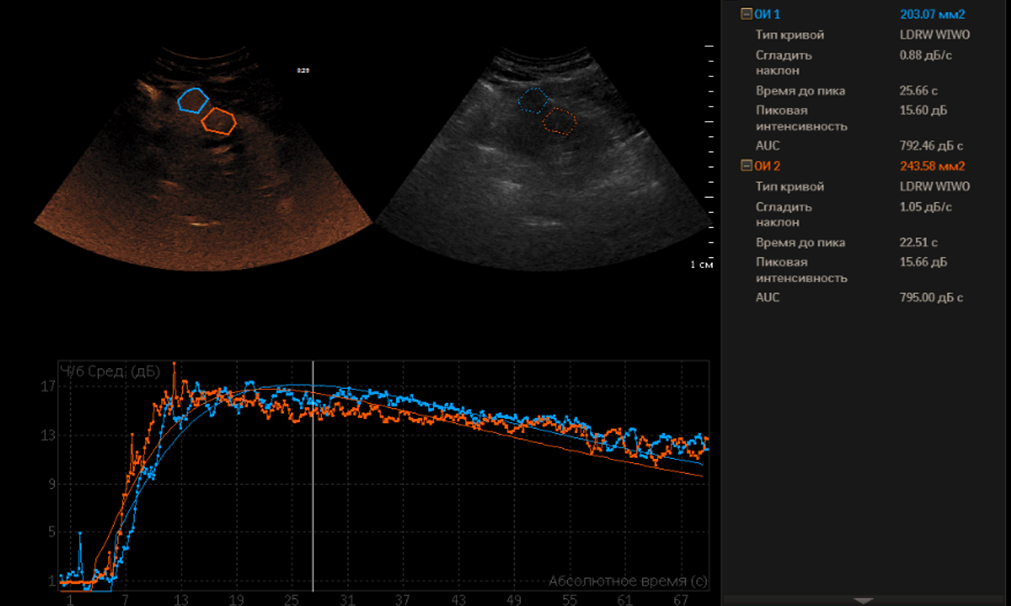
Рисунок 2. Количественные параметры, получаемые в программе, по которым проводился анализ.
Качественный анализ КУУЗИ опухолей почек был проведён по следующим критериям:
1. однородность контрастирования опухоли (1 – однородное, 2 – неоднородное);
2. интенсивность контрастирования опухоли относительно паренхимы (1 – выше паренхимы, 2 – ниже паренхимы);
3. время поступления ультразвукового контрастного препарата в опухоль относительно паренхимы (1 – раньше, чем в паренхиму; 2 – одновременно с паренхимой; 3 – позже, чем в паренхиму);
4. время вымывания ультразвукового контрастного препарата из опухоли относительно паренхимы (1 – раньше, чем из паренхимы, 2 – одновременно с паренхимой, 3 – позже, чем из паренхимы);
5. время поступления ультразвукового контрастного препарата в опухоль (с), 6. время поступления ультразвукового контрастного препарата в паренхиму (с);
7. время вымывания ультразвукового контрастного препарата из опухоли (с), 8. время вымывания ультразвукового контрастного препарата из паренхимы (с).
Последние 4 параметра по сути являются количественными, но поскольку данные параметры оценивались при визуальной оценке, они были отнесены к качественному анализу.
Таблица 1. Признаки количественного анализа КУУЗИ злокачественных опухолей почек (n = 31).
| AS, дБ/с | TTP, с | PI, дБ | Индекс AS | Индекс TTP | Индекс PI | |
| Светлоклеточный рак (n=31) | 1,90 4,32 ± 9,95 0,77–2,50 0,25–32,28 0,18–46,72 | 23,80* 22,37 ± 9,28 14,80–27,58 7,01–43,49 5,42–43,98 | 14,53* 16,55 ± 11,91 9,94–19,69 4,49–48,10 1,10–57,43 | 1,48* 1,55 ± 0,43 1,15–1,90 0,85–2,22 0,83–2,36 | 0,90 0,99 ± 0,35 0,74–1,18 0,57–1,82 0,43–2,11 | AS, дБ/с TTP, с PI, дБ Индекс AS Индекс TTP Индекс PI Светлоклеточный рак (n=31) 1,90 4,32 ± 9,95 0,77–2,50 0,25–32,28 0,18–46,72 23,80* 22,37 ± 9,28 14,80–27,58 7,01–43,49 5,42–43,98 14,53* 16,55 ± 11,91 9,94–19,69 4,49–48,10 1,10–57,43 1,48* 1,55 ± 0,43 1,15–1,90 0,85–2,22 0,83–2,36 0,90 0,99 ± 0,35 0,74–1,18 0,57–1,82 0,43–2,11 0,78 0,80 ± 0,29 0,55–1,01 0,35–1,29 0,34–1,40 Группа сравнения №1 (неизмененная паренхима рядом со злокачественными образованиями) (n = 31) 0,92# 2,46 ± 5,05 0,56–1,54 0,15–17,50 0,11–23,18 21,36# 23,21 ± 9,58 15,89–26,42 12,48–47,10 10,05–48,24 17,33# 21,04± 13,41 13,07–25,31 4,86–51,88 2,46–64,19 |
| Группа сравнения №1 (неизмененная паренхима рядом со злокачественными образованиями) (n = 31) | 0,92# 2,46 ± 5,05 0,56–1,54 0,15–17,50 0,11–23,18 | 21,36# 23,21 ± 9,58 15,89–26,42 12,48–47,10 10,05–48,24 | 17,33# 21,04± 13,41 13,07–25,31 4,86–51,88 2,46–64,19 |
При сравнении оценивались: интенсивность контрастирования опухоли относительно паренхимы; время поступления контрастного препарата в опухоль относительно паренхимы; время вымывания контрастного препарата из опухоли относительно паренхимы. В случае неоднородного контрастирования опухоли учитывался наиболее контрастируемый ее участок. Такой же принцип был применён для оценки времени поступления в опухоль и времени вымывания из опухоли.
При проведении количественного анализа параметры автоматически рассчитывались по кривой “время–интенсивность”, которую выводила программа после обработки кинопетли. Статистический анализ проводился по следующим, автоматически рассчитываемым, параметрам:
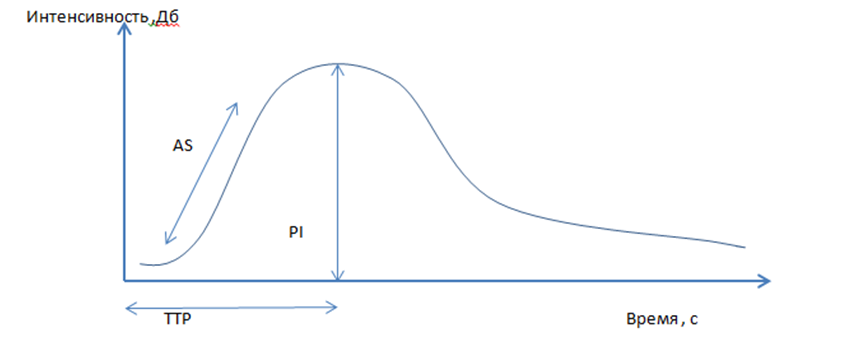
Рисунок 3. Количественные параметры, получаемые в программе, по которым проводился анализ.
1) наклон при подъеме (AS (ascending slope)) (дБ/с),
2) время до пика интенсивности (TTP (time to peak) (с),
Нами проанализированы параметры, которые автоматически рассчитывались при использовании программного обеспечения. Были получены достоверные различия между группами злокачественных образований с группой сравнения: PI при р< 0,005, TTP при р=0,001. По признаку AS достоверные различия были выявлены в этих группах (сравнение параметра в опухолях и рядом расположенной неизмененной паренхиме).
Визуально КУУЗИ может быть, как дополнительный, так и основной метод контроля после малоинвазивного лечения. В режиме реального времени после проведения абляции под контролем УЗИ появившиеся артефакты в зоне абляции (газ, дым) исчезали через 5-10 мин, тогда мы оценивали зону абляции с использованием контрастного препарата. При удовлетворительном лечении зона абляции — анконтрастная и, преимущественно, больше размеров первичного очага. У 25 пациентов зона абляции – анконтрастная.
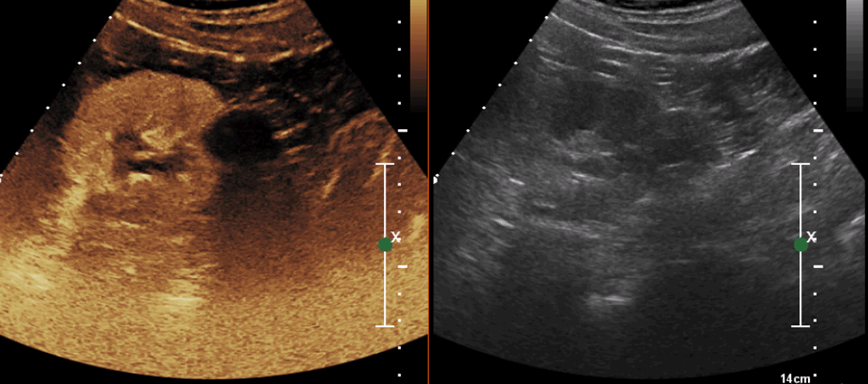
Рисунок 4. Опухоль левой почки. На протяжении всего исследования анконтрастная зона в области абляции. Контрастное исследование через 6 месяцев после РЧА. Оптимально выполненное РЧА.
У 7 из 32 пациентов отмечалось наличие анконтрасных участков в сочетании с гипоконтрастными участками, что было расценено как неадекватная абляция. У 4 пациентов выполнена биопсия с подтверждением остаточной опухли и повторная абляция. У всех 4-х пациентов –вторая абляция – адекватная. Вся зона-анконтрастная.
3 пациента из-за тяжести соматического состояния оставлены под динамическое наблюдение. У 1-го из них отмечается медленный продолженный рост опухоли.
В процессе динамического контроля оценка зоны контрастирования также интерпретировалась нами, как гиперконтрастная зона – наличие участка повышенного контрастирования, изоконтрастная зона – контрастирование, сопоставимое с нормальными здоровыми тканями, гипоконтрастная зона– участок пониженного контрастирования в сравнении со здоровой паренхимой почки в момент контрастирования, анконтрастная зона — участок который на момент контрастирования был без признаков контрастирования. Мы считали, что зона, оптимально выполненной, РЧА выглядит, как сферическая анконтрастная зона без признаков контрастирования, превышающая размеры опухоли, как минимум на 2-3 мм. Гиперконтрастный, изоконтрастный участок в зоне абляции трактовался нами, как остаточная зона, неподверженная термической обработке. Гипоконтрастный участок мы подозревали, как проходящий сосуд, частично подверженный термической обработкой, и пациенты с такими данными были отправлены под динамическое наблюдение. Анконтрастный участок в зоне абляции, мы описывали, как оптимальная выполненная абляция (Рис.5). В случае, если имеется остаточная зона в области абляции, будет выглядеть в последующем как «полумесяц» (Рис.5).
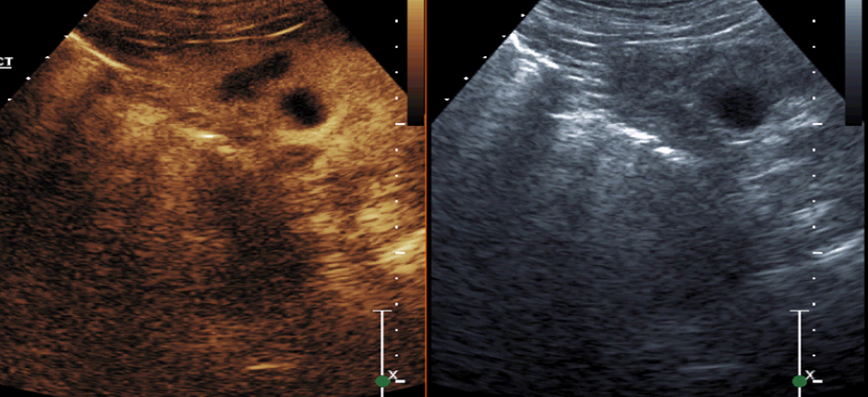
Рисунок 5. Рак правой почки. Состояние после РЧА через 1 месяц. Артериальная фаза, 23 секунда. Гипоконтрастный участок в области абляции в виде «полумесяца», что совпадает с данными, полученными из зарубежных источников.
4-м пациентам из 7 была выполнена повторная абляция. При контрольном исследовании отмечалось полное отсутствие контрастного препарата в зоне абляции. Трое пациентов были отправлены под динамическое наблюдение в связи с подозрением на наличие рецидива в зоне абляции. Чувствительность, специфичность, точность метода составило соответственно (78,13%, 90,63% и 84,37%). Положительное предсказывающее значение 89,29%. Отрицательное предсказывающее значение 80,56%.
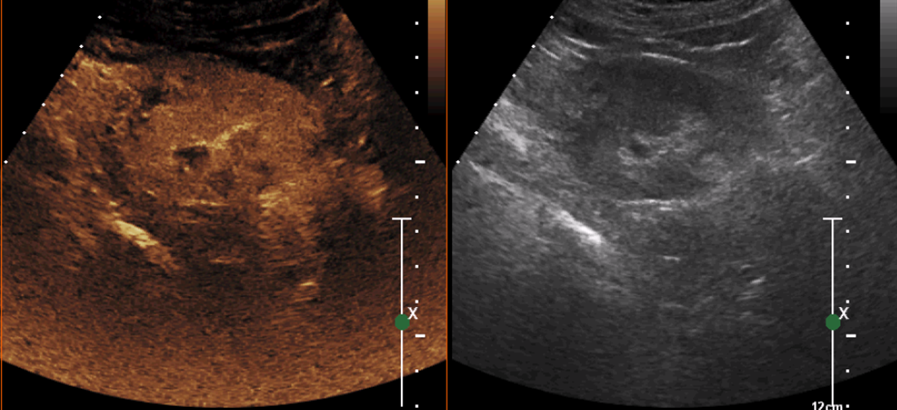
Рисунок 6. Тот же пациент через 3 месяца после абляции. Изоконтрастирование в зоне абляции, по периферии — гиперконтрастирование. Остаточная опухоль после абляции, расположенная рядом киста сдавлена. Пациент отправлен на повторное лечение.
Клинические примеры проведённого исследования
Пациент Г. 81 год. По поводу ДГПЖ длительное время наблюдался у уролога по месту жительства. При контрольном обследовании обнаружили опухоль левой почки. Было принято решение о динамическом наблюдении. В ноябре 2016 года была выполнена КТ органов брюшной полости без контрастирования (в связи с наличием аллергической реакции): в паренхиме в средней трети левой почки визуализируется опухоль размером в диаметре до 23 мм. Самостоятельно обратился в МНИРЦ им. П.А. Герцена для дообследования и лечения. Госпитализирован в отделение Онкоурологии.
Морфологическое заключение: фрагмент ткани почки с нефросклерозом, у края которого определяются комплексы из мелких эозинофильных клеток, подозрительных по принадлежности к онкоцитоме.
С учетом наличия тяжелых сопутствующих заболеваний пациенту принято решение выполнить малоинвазивное вмешательство в объеме селективной эмболизации ветвей почечной артерии с РЧА опухоли левой почки. Послеоперационный период без осложнений. Пациент выписан в удовлетворительном состоянии на 5 сутки. Через месяц пациент явился для контрольного обследования — было принято решение о проведения КУУЗИ левой почки после проведенной РЧА (Рис.7). Выявлена не равномерная зона РЧА с сомнительными признаками остаточной опухоли. Рядом расположена простая киста, которая на протяжении всего исследования оставалась анконтрастной. С учетом морфологической принадлежности опухоли, а также не больших размеров было принято решение оставить пациента под динамическое наблюдение. Предварительное заключение не оптимально выполненная РЧА.
Через 3 месяца при контрольном обследовании наблюдается выраженное изоконтрастирование зоны абляции, с признаками сдавления рядом расположенной кисты. Остаточная опухоль в зоне РЧА. Пациенту было рекомендовано пройти повторное лечение.
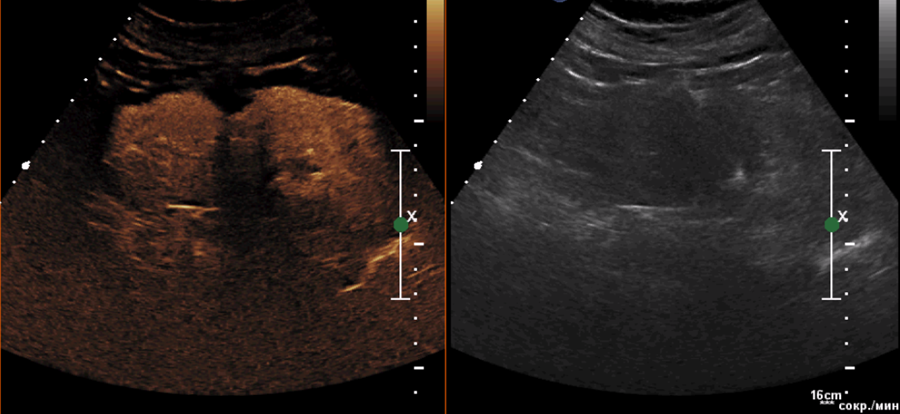
Рисунок 7. Опухоль левой почки. Через месяц после проведенного РЧА. Оптимально выполненное лечение. Тонкой стрелкой указан несущий сосуд, частично не подвергнувшийся абляции. Ошибочно принимаемый за остаточную часть опухоли. Оптимально выполненное РЧА.
Обсуждение.
РЧА в настоящее время находит довольно широкое применение в лечении опухолей почек малых размеров. Использование препарата Соновью позволяет проводить контроль за зоной абляции у пациентов с хронической почечной или печеночной недостаточностью, требующие строгого динамического контроля для своевременного выявления рецидива или диагностики остаточной ткани, не подвергшейся абляции [1,2,6]. Вопрос о применении КУУЗИ в качестве дополнительной диагностики и контроля РЧА почек обсуждается постоянно. У пациентов с опухолями почек более 2,5 см, которым невозможно провести хирургическое лечение в виду особых причин (наличия сопутствующих соматических отклонений, единственной почки), если имеются высокие риски оставления опухолевой ткани при проведении малоинвазивного лечения, есть необходимость провести КУУЗИ непосредственно сразу после абляции. Данная методика позволит визуализировать остаточную ткань и, как следствие, возможно переставить иглу в участок, не подверженный абляции. При опухолях без высокого риска (не превышающих 2-2,5 см) наиболее оптимальным будет возможность проведения КУУЗИ через 5-7 дней после абляции перед выпиской пациента. Принимая во внимание полученные результаты, хотелось отметить, что, как и все методы лечения онкологических пациентов, этот метод требует динамического контроля.
Оптимальной зоной выполненного РЧА при КУУЗИ является сферическая анконтрастная зона, превышающая размеры первичной опухоли. Однако, непосредственно после абляции КТ и МРТ не выполняется. При помощи КУУЗИ вполне можно оценить зону абляции сразу в операционной непосредственно после проведенного лечения.
Остаточная зона определяется как изо-гиперконтрастный участок различной формы в зоне РЧА. Гипоконтрастные участки можно оставить под динамическое наблюдение, так как бывает, что рядом проходящие сосуды имитируют остаточную ткань опухоли. Конечно, точность КТ и МРТ обладает более высоким потенциалом, но при невозможности проведения данных методик исследования стоит прибегнуть к КУУЗИ, как альтернативному способу исследования. Учитывая полученные результаты, КУУЗИ показывает хорошие результаты и может использоваться в динамическом наблюдении при малоинвазивных методах лечения. Также хотелось бы отметить тот факт, что данные, полученные нами, несмотря на разные временные рамки для контроля после РЧА, совпадают с данными зарубежных коллег.
При проведении собственного исследования применения КУУЗИ как основного, так и дополнительного метода контроля после малоинвазивного лечения были сделаны следующие выводы:
- Анконтрастные зоны в зоне опухоли — оптимально выполненное РЧА.
- Гиперконтрастный, изоконтрастный участок в зоне абляции трактовался нами как остаточная зона неподверженная термической обработке. У n=7 пациентов диагностирована остаточная ткань в зоне абляции в первые месяцы после РЧА. Далее 4 пациентам из 7 выполнена повторная абляция, при контрольном исследовании отмечается полное отсутствие контрастного препарата в зоне абляции, 3 пациента отправлены под динамическое наблюдение в связи с подозрением на наличие рецидива в зоне абляции.
- Наиболее оптимальными промежутками для контрольного исследования после малоинвазивного лечения при опухолях с высоким риском остаточной ткани непосредственно сразу после абляции. При опухолях без высокого риска (не превышающих 2-2,5 см) наиболее оптимальным будет возможность проведения через 5-7 дней после абляции перед выпиской пациента. И далее, как дополнительный или основной метод исследования в сравнении с КТ или МРТ каждые 3 месяца в первый год после лечения.
Таким образом, на основании вышеизложенных результатов данного исследования, при помощи КУУЗИ почек можно проводить оценку эффективности выполнения РЧА злокачественных образований почек у пациентов, которым было отказано в выполнении хирургического лечения.
Список литературы.
1. Cai Y., Du L., Li F., Gu J., Bai M. Quantification of enhancement of renal parenchymal masses with contrast-enhanced ultrasound // Ultrasound Med. Biol. 2014. V. 40. No. 7. P. 1387–1393. Doi: 10.1016/j.ultrasmedbio.2014.02.003.
2. Kasoji S.K., Chang E.H., Mullin L.B., Chong W.K., Rathmell W.K., Dayton P.A. A pilot clinical study in characterization of malignant renal-cell carcinoma subtype with contrast-enhanced ultrasound // Ultrason. Imaging. 2017. V. 39. No. 2. P. 126–136. Doi: 10.1177/0161734616666383.
3. Lu Q., Li C.X., Huang B.J., Xue L.Y., Wang W.P. Triphasic and epithelioid minimal fat renal angiomyolipoma and clear cell renal cell carcinoma: qualitative and quantitative CEUS characteristics and distinguishing features // Abdom. Imaging. 2015. V. 40. No. 2. P. 333–342. Doi: 10.1007/s00261-014-0221-y.
4. Li C.X., Lu Q., Huang B.J., Xue L.Y., Yan L.X., Zheng F.Y., Wen J.X., Wang W.P. Quantitative evaluation of contrast-enhanced ultrasound for differentiation of renal cell carcinoma subtypes and angiomyolipoma // Eur. J. Radiol. 2016. V. 85. No. 4. P. 795–802. Doi: 10.1016/j.ejrad.2016.01.009.
5. Chen L., Wang L., Diao X., Qian W., Fang L., Pang Y., Zhan J., Chen Y. The diagnostic value of contrast-enhanced ultrasound in differentiating small renal carcinoma and angiomyolipoma // Biosci. Trends. 2015. V. 9. No. 4. P. 252–258. Doi: 10.5582/bst.2015.01080.
6. Bertolotto M., Bucci S., Valentino M., Curro F., Sachs C., Cova M.A. Contrast-enhanced ultrasound for characterizing renal masses // Eur. J. Radiol. 2018. V. 105. P. 41–48. Doi: 10.1016/j.ejrad.2018.05.015.
7. King K.G., Gulati M., Malhi H., Hwang D., Gill I.S., Cheng P.M., Grant E.G., Duddalwar V.A. Quantitative assessment of solid renal masses by contrast-enhanced ultrasound with time-intensity curves: how we do it // Abdom. Imaging. 2015. V. 40. No. 7. P. 2461–2471. Doi: 10.1007/s00261-015-0468-y.
Для цитирования: Митина Л. А., Степанов С. О., Ратушная В. В., Долгачева Д. В.,
Соловьев В. А., Малекин К. А. Применение ультразвукового исследования
с контрастированием для оценки эффективности выполнения абляции опу-
холи почки. Медицинский алфавит. 2022; (31): 40–45. https://doi.org/10.33667
/2078‑5631‑2022‑31‑40‑45.
For citation: Mitina L. A., Stepanov S. O., Ratushnaya V. V., Dolgacheva D. V., Soloviev
V. A., Malekin K. A. Use of contrast-enhanced ultrasound in evaluating effectiveness
of kidney tumor ablation. Medical alphabet. 2022; (31):40–45. https://doi.org/10
.33667/2078‑5631‑2022‑31‑40‑45.

