В. И. Мазуров2, И. Б. Беляева1,2, А. Л. Чудинов1, О. В. Инамова1
1СПб ГБУЗ «Клиническая ревматологическая больница № 25», Санкт-Петербург
2ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И. И. Мечникова» Минздрава России, Санкт-Петербург
РЕЗЮМЕ
В статье представлен анализ особенностей клинического течения, а также основных осложнений у пациентов c АНЦА- ассоциированными системными васкулитами (гранулематоз с полиангиитом, микроскопический полиангиит, эозинофильный гранулематоз с полиангиитом) и больных узелковым полиартериитом в течение первых трех лет заболевания. Оценена взаимосвязь осложнений с длительной глюкокортикостероидной терапией. Больные гранулематозом с полиангиитом имели наиболее неблагоприятное течение заболевания с высоким риском осложнений. Выявлена высокая частота развития ишемических инсультов и формирования хронической болезни почек у больных с микроскопическим полиангиитом. Проанализированы случаи осложнений и летальных исходов при первичных некротизирующих системных васкулитах.
КЛЮЧЕВЫЕ СЛОВА: АНЦА-ассоциированные системные васкулиты, гранулематоз с полиангиитом, микроскопический полиангиит, эозинофильный гранулематоз с полиангиитом, узелковый полиартериит, осложнения.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы заявляют об отсутствии конфликта интересов.
Complications and causes of mortality in patients with primary necrotizing systemic vasculitis
V.I. Mazurov2, I.B.Belyaeva1,2, A. L. Chudinov1, O. V. Inamova1
1Clinical Rheumatology Hospital No. 25, Saint Petersburg, Russia
2North-Western State Medical University n.a. I. I. Mechnikov, Saint Petersburg, Russia
SUMMARY
The article reviews the clinical symptoms, main complications in patients with ANCA-associated systemic vasculitis (granulomatous with polyangiitis, microscopic polyangiitis, eosinophilic granulomatous with polyangiitis) and polyarteritis nodosa during the first three years of the disease. We evaluated the relationship between complications and long-term glucocorticosteroid therapy. Patients with granulomatosis had the most unfavourable course of the disease with a high risk of complications. A high incidence of ischemic strokes and chronic kidney disease in patients with microscopic polyangiitis has been identified. We also analyzed cases of lethal outcomes in patients with primary systemic vasculitis.
KEY WORDS: ANCA-associated systemic vasculitis, granulomatous with polyangiitis, microscopic polyangiitis, eosinophilic granulomatous with polyangiitis, polyarteritis nodosa, complications.
CONFLICT OF INTEREST. The authors declare no conflict of interest.
Введение
Первичные некротизирующие системные васкулиты (ПНСВ) – группа аутоиммунных заболеваний, при ко- торых развивается некротизирующее воспаление сосудов с развитием ишемических изменений в органах и тканях, кровоснабжаемых соответствующими сосудами [1]. В группу ПНСВ с поражением сосудов мелкого и среднего калибра входят гранулематоз с полиангиитом (ГПА), микроскопический полиангиит (МПА), эозинофильный гранулематоз с полиангиитом (ЭГПА), узелковый полиартериит (УП) [2]. ГПА – аутоиммунное заболевание, характеризующееся гранулематозным воспалением респираторного тракта и некротизирующим васкулитом сосудов мелкого калибра. Распространенность ГПА составляет примерно 2,3 случая на 100 тысяч человек [3]. МПА представляет собой малоиммунный некротизирующий васкулит сосудов мелкого калибра, в клинической картине которого превалируют проявления некротизирующего гломерулонефрита, реже – легочного капиллярита [4]. ЭГПА (или синдром Черджа – Стросс) является эозинофильным гранулематозным воспалением респираторного тракта с некротизирующим васкулитом, часто сочетающимся с бронхиальной астмой, аллергическим ринитом и экстравазальными эозинофильными гранулемами [5]. Другим ПСВ является УП – некротизирующий васкулит сосудов среднего калибра без гломерулонефрита и с частым формированием микроаневризм и тромбозов, приводящих к ишемии и инфаркту различных органов [6]. Некротизирующее воспаление сосудов мелкого и среднего калибра обусловливает тяжесть и полиорганность поражения при ПНСВ. В связи с этим актуальной является задача изучения особенностей клинического течения для наиболее ранней диагностики ПНСВ и своевременного назначения адекватной пато генетической терапии.
Цель исследования: определить особенности клинического течения, характера осложнений и причин летальности при ПНСВ в течение первых трех лет заболевания.
Материалы и методы
В исследование было включено 232 пациента с первичными системными некротизирующими васкулитами (ПНСВ), находившихся на стационарном лечении в КРБ № 25 и СЗГМУ имени И. И. Мечникова в период 2010–2018 годов. Постановка диагноза проводилась в соответствии с критериями Американской коллегии ревматологов (1990).
Основную группу составили пациенты с АНЦА-СВ (n = 209), в группу сравнения вошли больные с УП (n = 23), их них 134 женщины и 98 мужчин. Длительность заболевания на момент включения в исследование составляла от 1 до 12 месяцев (6,7 ± 1,3 месяца). Пациенты основной группы были разделены на три подгруппы в зависимости от нозологической принадлежности: ГПА (n = 94), МПА (n = 46) и ЭГПА (n = 69) (рис. 1).
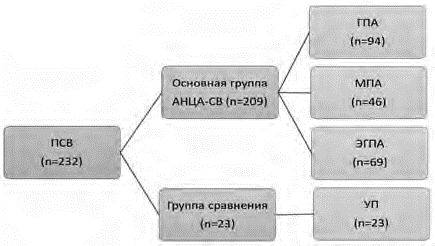
Рисунок 1. Распределение пациентов с СВ в зависимости от нозологической принадлежности
Критерии включения в исследование:
- дебют заболевания в возрасте старше 18 лет;
- соответствие установленных диагнозов критериям Американской коллегии ревматологов (1990);
- морфологическое подтверждение диагноза при отсутствии АНЦА-позитивности;
- длительность заболевания на момент поступления в ревматологический стационар – менее года.
Результаты исследования
При изучении частоты и характера поражения различных органов и систем у больных ПНСВ в течение первых трех лет заболевания установлено, что поражение ЛОР- органов превалировало в клинической картине больных с ГПА (87 %) в варианте синуситов (57 %), отитов (39 %), субглоточного стеноза гортани (16 %), язвенно-некроти- ческого ринита (63 %), нередко сочетающегося с деформацией носовой перегородки (9 %). Поражение ЛОР-органов у больных ЭГПА отмечалось реже (у 50 %), а при МПА и УП почти не определялось. Развитие гнойного отита, потребовавшего госпитализации в ЛОР-стационар, определялось у 7 % больных с ГПА.
Поражение сердечно-сосудистой системы чаще развивалось при ЭГПА и МПА (38,0 и 35,0 % соответственно) преимущественно в варианте коронариита и перикардита. При ГПА и УП это поражение развивалось реже (21,0 и 27,5 % соответственно). Формирование венозных тромбозов отмечалось у 3 (7,1 %) пациентов с МПА, 6 (9,2 %) больных с ЭГПА, 2 (8,2 %) больных с УП и реже – при ГПА – у 5 (4,7 %) больных.
Поражение центральной нервной системы в варианте церебрального васкулита отмечалось чаще у пациентов с АНЦА-СВ (МПА – 22 %, ГПА – 17 %, ЭГПА – 13), нежели в когорте пациентов с УП (4 %). Подобная закономерность прослеживалась и при оценке частоты развития инсультов. Частота и характер сердечно-сосудистых и цереброваску- лярных осложнений при ПНСВ представлены в таблице 1. Поражение периферической нервной системы (ПНС) в варианте ишемической полинейропатии наиболее часто отмечалось у больных УП (83 %), МПА (65 %) и ЭГПА (65 %), а при ГПА развивалось только в трети случаев.
Таблица 1
Частота и характер сердечно-сосудистых и цереброваскулярных осложнений у пациентов с ПНСВ (n = 232)
| 1 | 2 | 3 | 4 | P-value | |
| Осложнение | ГПА, % (n = 94) | МПА, % (n = 46) | ЭГПА, % (n = 69) | УП, % (n = 23) | |
| Инфаркт миокарда | 1 | 2 | 5 | 9 | – |
| Тромбоэмболия легочной артерии | 0 | 5 | 8 | 4 | P1–3 = 0,020 |
| Инсульт | 10 | 21 | 11 | 0 | P1–4 = 0,002; P2–4 = 0,002 |
| Повторный инсульт | 1 | 12 | 5 | 0 | P1–2 = 0,010 |
По нашим данным, поражение легких в течение первых трех лет заболевания развивалось практически у всех больных с ЭГПА (99 %) преимущественно в варианте синдрома бронхиальной астмы (97 %), реже – в варианте мигрирующих эозинофильных инфильтратов (64 %). Отмечено достоверно более частое поражение легких при ГПА (84 %), чем при МПА (59 %); p < 0,001. Важно отметить, что у больных ГПА преимущественно определялись инфильтраты с распадом легочной ткани (70 %), а у больных МПА – проявления легочного капиллярита (50 %). В 28 % случаев при ГПА отмечалось кровохарканье, иногда с формированием легочного кровотечения, что существенно превышало данный показатель при трех других нозологиях (менее 4 % случаев); p < 0,002. В одном случае при ГПА легочное кровотечение, возникшее на фоне высокой активности заболевания и образования множественных инфильтратов с полостями распада, привело к летальному исходу.
Поражение кожи наиболее часто отмечалось у больных УП (83 %) в виде пурпуры и язвенно-некротических изменений, что достоверно (p < 0,010) превышало частоту поражения кожи в когорте пациентов с АНЦА-СВ (56 %) (p < 0,010). Проявления ишемической гангрены дистальных фаланг пальцев отмечались у 35 % пациентов с УП и в единичных случаях при ГПА и МПА (1 и 2 % соответственно), что требовало проведения оперативного лечения. При этом не выявлено достоверной корреляции между развитием ишемии конечностей и проводимой патогенетической терапией. Характерной особенностью клинического течения ГПА является частое поражение органов зрения (36 %) в виде формирования ретробульбарной гранулемы (16 %) и коньюнктивита (16 %). Эписклерит и увеит отмечались реже (соответственно у 11 и 13 % больных). Важно уточнить, что у 7 (8 %) пациентов с ГПА для верификации диагноза проводилась биопсия тканей орбиты. Поражение глаз при МПА, ЭГПА и УП диагностировалось значительно реже в течение первых трех лет заболевания. В таблице 2 приведены наиболее часто встречающиеся осложнения со стороны органов зрения у пациентов ГПА.
Таблица 2
Основные осложнения со стороны органов зрения у больных ГПА (n = 94)
| Тип осложнения | Частота, % |
| Компрессия зрительного нерва | 11 |
| Перфорация роговицы | 3 |
| Потеря зрения | 5 |
| Энуклеация глаза | 2 |
Поражение почек в течение первых трех лет заболевания отмечалось у 96 % больных МПА и у 78 % больных ГПА в варианте малоиммунного гломерулонефрита с полулуниями. Быстропрогрессирующий вариант гломерулонефрита достоверно чаще отмечался в когорте больных МПА (48 %), нежели в когорте больных с ГПА (19 %) (p < 0,001). Значительно реже поражение почек встречалось при ЭГПА (38 %) и УП (26 %), а быстро прогрессирующий вариант гломерулонефрита у этих пациентов развивался в менее чем 3 % случаев. Формирование хронической болезни почек (ХБП) в ходе нашего исследования отмечалось чаще при МПА (61 %) и достоверно реже при ГПА и ЭГПА (12 и 24 % случаев) (p < 0,010). Терминальная стадия ХБП, потребовавшая проведения процедур гемодиализа, была отмечена у 15 % больных МПА и у 5 % больных с ГПА.
Поражение желудочно-кишечного тракта развилось у 21 % больных АНЦА-СВ и значительно реже при УП (4 %); p < 0,001. Желудочно-кишечные кровотечения отмечались в ходе заболевания у 5,6 % больных АНЦА-СВ, что всегда требовало экстренного перевода в хирургический стационар. Поражения опорно-двигательного аппарата чаще диагностировались у пациентов с УП (83 %) и МПА (80 %), и несколько реже – при ГПА и ЭГПА (50 и 52 % случаев соответственно). Гнойный артрит в течение первых трех лет осложнял течение заболевания у 2,3 % больных АНЦА-СВ. Формирование асептического некроза головки бедренной кости происходило у 5 % больных УП, а также у 2 % больных с АНЦА-СВ. У 2 % наблюдаемых пациентов с ГПА развивался остеомиелит.
Инфекционные осложнения, потребовавшие госпитализации наблюдаемых пациентов, выявлялись чаще при МПА (23 %), реже – при ГПА (19 %), УП (15 %) и ЭГПА (13 %). При этом формирование сепсиса в течение первых трех лет произошло у 3 пациентов с ГПА и 1 пациента с МПА. Внебольничные пневмонии на фоне иммуносу- прессивной терапии в первые три года болезни развились у 4,5 % больных при всех ПНСВ.
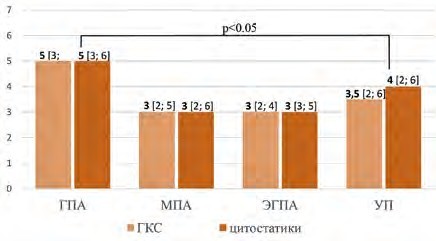
| Рисунок 2. Медиана времени от дебюта клинических проявлений до назначения патогенетической терапии, месяцы, Me [LQ; HQ] |
При оценке проводимой патогенетической терапии установлено, что срок назначения глюкокортикостероидов (ГКС) и цитостатиков от момента дебюта клинических проявлений заболевания оказался наибольшим в группе больных ГПА (рис. 2).
Важно уточнить, что в течение первого года заболевания цитостатическая терапия назначалась в 93 % случаев при ГПА, в 85 % – при МПА, в 47 % – при ЭГПА и в 78 % – при УП (табл. 3). Наиболее часто для индукции ремиссии назначался циклофосфамид.
Таблица 3
Первый цитостатический препарат, назначенный в дебюте ПНСВ (n = 232)
| Нозология | Циклофосфамид, % | Азатиоприн, % | Микофенолата мофетил, % | Метотрексат, % |
| ГПА (n = 94) | 78 | 11 | 2 | 2 |
| МПА (n = 46) | 65 | 18 | 2 | |
| ЭГПА (n = 69) | 29 | 18 | ||
| УП (n = 23) | 61 | 17 |
В одном случае при ГПА в качестве препарата первой линии был использован блокатор пролиферации В-клеток ритуксимаб. Всего за время исследования 14 пациентов получали терапию ритуксимабом (ГПА – 12, МПА – 2) и 1 пациент с ГПА получал терапию белимумабом. Терапию внутривенными иммуноглобулинами получили 8 больных ГПА и 1 больной МПА.
В ходе индукции ремиссии у 4 % пациентов с ГПА имело место формирование геморрагического цистита как проявление лекарственного осложнения на фоне терапии циклофосфамидом. Бирмингемский индекс активности BVAS (версия 3) был подсчитан у всех пациентов на момент назначения патогенетической терапии. Наиболее высокий средний уровень индекса активности BVAS отмечался в когортах больных ГПА и МПА и оказался достоверно более высоким, нежели в группах больных с ЭГПА и УП (p < 0,010) (рис. 3). Рефрактерность к первоначально назначенной патогенетической терапии, то есть отсутствие регресса клинической активности в течение 6 недель лечения, отмечалась у 39 % пациентов с УП, реже – при ГПА и МПА (28 и 27 % случаев соответственно), а при ЭГПА регистрировалась только в 7 % случаев.
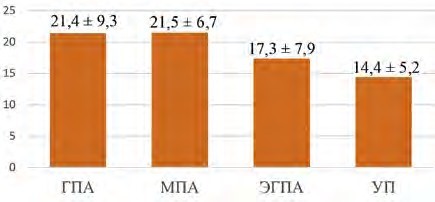
| Рисунок 3. Средний уровень индекса активности BVAS к моменту назначения патогенетической терапии, баллы |
Такие осложнения, как стероидный диабет, остеопороз и компрессионные переломы позвонков, кандидоз чаще всего были связаны с длительным приемом высоких доз ГКС в связи с рефрактерным течением заболевания (табл. 4).
Таблица 4
Осложнения, ассоциированные с длительным приемом ГКС у больных ПНСВ (n = 232)
| Осложнение | ГПА, % | МПА, % | ЭГПА, % | УП, % |
| Сахарный диабет 2 типа | 26* | 5 | 11* | 9 |
| Кандидоз | 10 | 9 | 5 | 4 |
| Остеопороз | 23 | 28 | 23 | 30 |
| Компрессионные переломы позвонков | 14 | 19 | 7 | 15 |
Примечание: * – p < 0,020.
Проведен анализ причин летальных исходов у больных с ПНСВ в течение первых трех лет заболевания. Всего за- фиксировано 11 (4,7 %) летальных исходов: ГПА – 5 (5,3 %) случаев, МПА – 4 (8,7 %) случая, ЭГПА – 1 (1,4 %) случай, УП – 1 (4,3 %) случай. В 2 (0,9 %) случаях (ГПА – 1, МПА – 1) причиной летальности была полиорганная недостаточность в рамках высокой активности ПНСВ после самостоятельной отмены патогенетической терапии. Инфекционные осложнения стали причиной летального исхода в 3 (1,3 %) случаях, а тромбоэмболические осложнения (инсульт, инфаркт миокард, тромбоэмболия легочной артерии) – в 5 (2,2 %) случаях (табл. 5). В группе пациентов с летальным исходом достоверно чаще отмечалось формирование ХБП к 12-му месяцу заболевания (71 %), нежели в группе пациентов без летального исхода (24 %); p < 0,005.
Таблица 5
Причины летальных исходов при ПНСВ
| № | Возраст, лет | Диагноз | Длительность болезни, лет | Причина летального исхода | Поражение в дебюте заболевания | ||
| Легкие | Сердце | Почки | |||||
| 1 | 36 | ГПА | 4 | Сепсис | + | – | + |
| 2 | 47 | ГПА | 2 | Легочное кровотечение | + | – | + |
| 3 | 75 | ГПА | 1 | Инфаркт миокарда | + | – | – |
| 4 | 48 | ГПА | 6 | Абсцесс ягодичной области, сепсис | + | + | + |
| 5 | 64 | ГПА | < 1 | Полиорганная недостаточность | + | – | + |
| 6 | 73 | МПА | 3 | Туберкулез | + | – | + |
| 7 | 72 | МПА | 1 | Ишемический инсульт | – | – | – |
| 8 | 62 | МПА | 1 | Полиорганная недостаточность | + | – | + |
| 9 | 28 | МПА | 2 | Массивная тромбоэмболия легочной артерии | + | + | – |
| 10 | 49 | ЭГПА | 3 | Инфаркт миокарда. Массивная тромбоэмболия легочной артерии | + | – | – |
| 11 | 47 | УП | 1 | Инфаркт миокарда | + | + | + |
В ходе исследования был произведен подсчет индекса органного повреждения при системных васкулитах (VDI) через 12 и 36 месяцев заболевания (рис. 4). Нами установлено, что среднее значение индекса VDI через 36 месяцев заболевания в группе больных ГПА было наибольшим (4,7 балла) и достоверно превосходило среднее значение индекса VDI на том же сроке болезни в группе больных с МПА, ЭГПА и УП (3,8, 2,7 и 3,1 балла соответственно). Эти данные свидетельствуют о прогностически неблагоприятном течении ГПА и высоком риске инвалидизации.
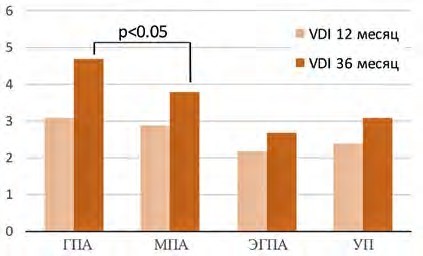
| Рисунок 4. Средний уровень индекса повреждения VDI на 12 и 36 месяцах заболевания, баллы |
Обсуждение
Наиболее часто осложнения при ПНСВ возникают в первый год заболевания в связи с поздним назначением патогенетической иммуносупрессивной терапии, а это, в свою очередь, связано с трудностью дифференциальной диагностики из-за крайне вариабельных вариантов дебюта и недостаточной информированности врачей первичного звена об особенностях клинического течения этой формы аутоиммунной патологии.
Течение ГПА часто осложняется поражением зрительного нерва, легочными кровотечениями, гнойными отитами и развитием стероидного диабета. При этом развивающиеся осложнения связаны как с поздним назна- чением патогенетической терапии, так и с осложнениями от иммуносупрессивной терапии. Позднее назначение цитостатической терапии ведет не только к более быстрому прогрессированию основного воспалительного процесса, но и к более длительному приему высоких доз ГКС, что увеличивает риск формирования таких осложнений, как инфекционные процессы, стероидный диабет и компрессионные переломы на фоне развития стероидного остеопороза.
Известно, что самая частая причина острой летальности в дебюте системных некротизирующих васкулитов – легочные кровотечения. Данное осложнение часто встречалось при ГПА и значительно реже – при МПА. По данным различных исследований, 5-летняя выживаемость при ГПА составляет 61–75 %, при МПА – 45–75 %, при УП – 60–80 %, а при ЭГПА – 68–100 % случаев. Отмечено, что предикторами высокой летальности являются пожилой возраст, развитие ХБП и наличие максимального повышения креатинина уже в первые месяцы болезни [8, 9]. Данные нашего исследования подтверждают эту закономерность.
Клиническое течение МПА определялось поражением почек с частым формированием ХБП, нередко с исходом
в терминальную стадию ХБП.
Среди тромбоэмболических осложнений необходимо отметить высокую частоту возникновения ишемических инсультов при МПА и высокую частоту развития инфаркта миокарда у больных УП, что требует применения высокодозных схем пульстерапии глюкокортикоидов и цитостатиков в дебюте заболевания у этой категории пациентов. В настоящее время зарегистрированы показания для применения блокаторов пролиферации В-клеток при АНЦА-ассоциированных формах СВ (ГП и МП) (ритуксимаб) при высокой активности и полиорганности поражения в дебюте заболевания. В нашем исследовании 14 пациентов получали эту терапию в дебюте заболевания, что позволило существенно снизить активность и индекс повреждения через 36 месяцев наблюдения за пациентами.
Высокая частота ишемического повреждения конечностей при УП требует проведения более агрессивной патогенетической терапии и обязательного использования антитромботических препаратов, особенно при подозрении на первые проявления ишемии конечностей.
Заключение
Многообразие вариантов клинического течения ПНСВ ставит перед врачами непростую задачу ранней диагностики и проведения активной иммуносупрессивной терапии. В связи с этим при планировании лечения пациентов с ПНСВ врач должен учитывать как сопутствующую патологию, так и вариант дебюта СВ с оценкой превалирующего поражения органов.
Факторами риска формирования значимых осложнений у таких пациентов являются длительный прием высоких доз глюкокортикостероидов, позднее назначение цитостатической терапии, формирование хронической болезни почек в первый год заболевания.
Причинами летальности в первые годы болезни являются полиорганная недостаточность в рамках активности ПНСВ, развившейся на фоне самостоятельной отмены патогенетической терапии, инфекционные и тромбоэмболические осложнения. Мониторинг и профилактика осложнений являются неотъемлемой задачей курации этих пациентов. Таким образом, ранняя диагностика и активная стратегия ведения пациентов с дебютом ПНСВ позволяют сохранить высокое качество их жизни на долгие годы и минимизировать риск осложнений и летальности при этих тяжелых системных заболеваниях.
Список литературы / References
- Клиническая ревматология. 3-е издание, переработанное и дополненное. Руководство для врачей. Под. ред. В. И. Мазурова. М.: Е-ното, 2021. C. 696.
Clinical rheumatology. 3rd edition, revised and enlarged. A guide for doctors. Under. ed. V. I. Ma- zurov. M.: E-noto, 2021. P. 696.
- Мазуров В. И. Ревматология. Фармакотерапия без ошибок. Руководство для врачей под ред. В. И. Мазурова, О. М. Лесняк: Е-ното, Москва, 2017. С. 479–505.
Mazurov V. I. Rheumatology. Pharmacotherapy without mistakes. A guide for physicians, ed. V. I. Mazurov, O. M. Lesnyak: E-noto, Moscow, 2017. P. 479–505.
- Mahr A, Guillevin L. Prevalences of polyarteriitis nodosa, microscopic polyangiitis, Wegener’s granulomatosis and Churg-Strauss syndrome in a French urban multiethnic population in 2000: a capture-recapture estimate. Arthritis Rheum. 2004, 51: P. 92–99.
- Watts RA, Scott DGI. Epidemiology of vasculitis. Oxford: Oxford University Press, 2008. P. 7–22.
- Richard A. Watts, David G. I. Scott. Vasculitis in Clinical Practice Springer-Verlag New York, 2010. P. 71–77.
- Насонов Е. Л., Баранов А. А., Шилкина Н. П. Васкулиты и васкулопатии. Ярославль: Верхняя Волга, 1999. Стр. 340–347.
Nasonov E. L., Baranov A. A., Shilkina N. P. Vasculitis and vasculopathies. Yaroslavl: Upper Volga, 1999. Pp. 340–347.
- Exley AR, Bacon PA, Luqmani RA et al. Development and initial validation of the Vasculitis Damage Index. Arthritis Rheum 1997; 40: 371–380.
- Booth AD, Almond MK, Burns A et al. Outcome of ANCA-associated renal vasculitis: a 5-year retrospective study. Am J Kidney Dis 2003; 41: 776–784.
- Drooger J.C, A Dees, and A.J.G Swaak. ANCA-Positive Patients: The Influence of PR 3 and MPO Antibodies on Survival Rate and The Association with Clinical and Laboratory Characteristics. Open
Rheumatol J. 2009; 3: 14–17.
Сведения об авторах
Мазуров Вадим Иванович, д.м.н., акад. РАН, зав. кафедрой2. E-mail: maz. nwgmu@yandex.ru. ORCID: 0000-0002-0797-205
Беляева Ирина Борисовна, д.м.н., проф., врач-ревматолог1, доцент кафедры2. E-mail: belib@mail.ru. ORCID: 0000-0002-7981-6349
Чудинов Антон Леонидович, к.м.н., зав. отделением1. E-mail: anton-chudinov@mail.ru. ORCID: 0000-0002-7675-5683
Инамова Оксана Владимировна, к.м.н., гл. врач1. E-mail: ovig74@mail.ru. ORCID: 0000-0001-9126-3639
1СПб ГБУЗ «Клиническая ревматологическая больница № 25», Санкт-Петербург
2 Кафедра терапии, ревматологии, экспертизы временной нетрудоспособности
и качества медицинской помощи им. Э. Э. Эйхвальда ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И. И. Мечникова» Минздрава России, Санкт-Петербург
Автор для переписки: Беляева Ирина Борисовна. E-mail: belib@mail.ru
About authors
Mazurov Vadim I., DM Sci (habil.), RAS academician, head of Dept2. E-mail: maz. nwgmu@yandex.ru. ORCID: 0000-0002-0797-205
Belyaeva Irina B., DM Sci (habil.), professor, rheumatologist1, associate professor at Dept2. E-mail: belib@mail.ru. ORCID: 0000-0002-7981-6349
Chudinov Anton L., PhD Med, head of Dept1. E-mail: anton-chudinov@mail.ru. ORCID: 0000-0002-7675-5683
Inamova Oksana V., PhD Med, chief physician1. E-mail: ovig74@mail.ru. ORCID: 0000-0001-9126-3639
1Clinical Rheumatology Hospital No. 25, Saint Petersburg, Russia
2North-Western State Medical University n.a. I. I. Mechnikov, Dept of Therapy, Rheumatology, Examination of temporary disability and the Quality of medical care n. a. E. E. Eichwald, Saint Petersburg, Russia
Corresponding author: Belyaeva Irina B. E-mail: belib@mail.ru

