В. Ю. Лобзин1,2,3, Д. С. Мальцев3, Е. С. Струментова1, М. А. Бурнашева3, С. С. Черемисин1
1ФГБОУ ВО «Северо-Западный государственный медицинский университет имени
И. И. Мечникова» Минздрава России, Санкт-Петербург
2ФГБУ «Детский научно-клинический центр инфекционных болезней» ФМБА России, Санкт-Петербург
3ФГБВОУ ВО «Военно-медицинская академия имени С. М. Кирова» Минобороны России, Санкт-Петербург
РЕЗЮМЕ
Болезнь Альцгеймера (БА) является наиболее распространенным нейродегенеративным заболеванием, вызывающим деменцию. Специфичность симптомов определяет диагноз БА, хотя точная его постановка возможна только посмертно. Нейропсихологическое тестирование является стандартом клинической диагностики БА, но требует больших затрат времени, не позволяет с полной точностью поставить диагноз, имеет высокую зависимость от правильности проведения тестов и, скорее, является дополнением к обследованию пациента. Выполнение люмбальной пункции и позитронно-эмиссионной томографии труднодоступно для рутинной оценки населения. Поскольку глаз является продолжением центральной нервной системы, изучение его изменений может привести к разработке ряда неинвазивных дифференциальных диагностических тестов для выявления пациентов с БА на ранних стадиях. В последние годы появление поддающихся количественной оценке методов визуализации с высоким разрешением, которые являются неинвазивными, быстрыми и широкодоступными, открыло новую область окулярно-нейронной визуализации. В данной статье мы проводим обзор современных зарубежных и отечественных исследований некоторых глазных биомаркеров и методов их исследования, которые потенциально могут быть использованы в ранней диагностике болезни Альцгеймера.
КЛЮЧЕВЫЕ СЛОВА: болезнь Альцгеймера, когнитивные нарушения, бета-амилоид, глаз, сетчатка, оптическая когерентная томография.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы заявляют об отсутствии конфликта интересов.
Ophthalmological markers of Alzheimer’s disease
V. Yu. Lobzin1,2,3, D. S. Maltsev3, E. S. Strumentova1, M. A. Burnasheva3, S. S. Cheremisin1
1North-Western State Medical University n. a. I. I. Mechnikov, Saint Petersburg, Russia
2Children’s Research and Clinical Centre for Infectious Diseases, Saint Petersburg, Russia 3Military Medical Academy n. a. S. M. Kirov, Saint Petersburg, Russia
SUMMARY
Alzheimer’s disease (AD) is the most common neurodegenerative disease-causing dementia. The severity of symptoms determines the diagnosis of AD, although an accurate diagnosis can only be made postmortem. Neuropsychological testing is the «gold standard» for early diagnosis of AD, but is time-consuming, does not allow a complete diagnosis with complete accuracy, is highly dependent on the correctness of the tests, and is rather an adjunct to the examination of the patient. Lumbar puncture and positron emission tomography are not available for routine screening of the population. Because the eye is an extension of the central nervous system, the study of its changes may lead to the development of a number of non-invasive differential diagnostic tests to identify patients with AD at an early stage. In recent years, the advent of quantifiable high-resolution imaging techniques that are non-invasive, rapid, and widely available has opened up a new field of ocular-neural imaging. In this paper, we review current foreign and domestic studies of some ocular biomarkers and the methods that could potentially be used in the early diagnosis of Alzheimer’s disease.
KEY WORDS: Alzheimer’s disease, cognitive impairment, amyloid-beta, eye, retina, optical coherence tomography.
CONFLICT OF INTEREST. The authors declare that they have no conflicts of interest.
Введение
Болезнь Альцгеймера (БА) – это прогрессирующее нейродегенеративное заболевание, характеризующееся гибелью нейронов и отложением в центральной нервной системе (ЦНС) внеклеточных бета-амилоидных бляшек (Aβ) и внутриклеточных нейрофибриллярных тау-клубков. Нейропсихологическая оценка является «золотым стандартом» для ранней диагностики БА и оценки ее прогрессирования, но тестирование требует больших затрат времени, не позволяет с полной точностью поставить диагноз, имеет высокую зависимость от правильности проведения тестов и, скорее, является дополнением к обследованию пациента. В 2018 году группой экспертов американского Национального института старения и Альцгеймеровской ассоциацией (NIA-АА) были выпущены обновленные рекомендации по диагностическому тестированию, формирующие биологическое определение БА на основе биомаркеров в рамках системы классификации ATN, установленной C. R. Jack et al. (2016) [1]. Однако выполнение люмбальной пункции и позитронно-эмиссионная томография (ПЭТ) с лигандами, тропными к бета-амилоиду (питтсбургская субстанция, Pib), и 18-фтордезоксиглюкозой недоступны для рутинного скрининга населения. Поскольку глаз является продолжением центральной нервной системы, изучение его изменений может привести к разработке ряда неинвазивных дифференциально-диагностических тестов для выявления пациентов с БА на ранних стадиях. В последние годы появление поддающихся количественной оценке методов визуализации с высоким разрешением, которые являются неинвазивными, быстрыми и широкодоступными, открыло новую область окулярно-нейронной визуализации. Таким образом, новый термин «окуломика» отражает важность использования глазных биомаркеров для диагностики и мониторинга ряда нейродегенеративных и системных заболеваний [2]. В данной статье мы проводим обзор современных зарубежных и отечественных исследований некоторых глазных биомаркеров и методов их исследования, которые потенциально могут быть использованы в ранней диагностике болезни Альцгеймера (рис. 1).
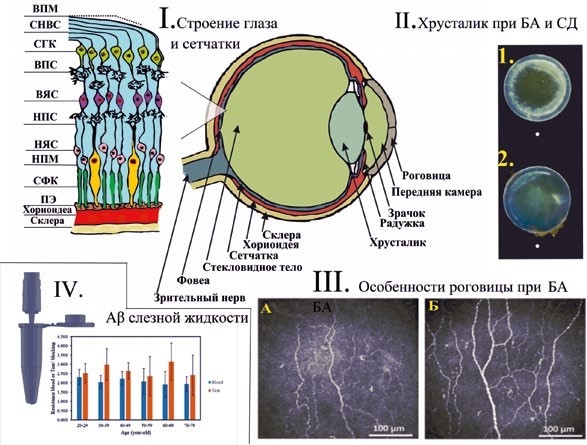
Слезная жидкость. Слеза представляет собой доступную для изучения биологическую жидкость, но является малоизученным источником биомаркеров. Протеомный состав слезного слоя исследовался при некоторых нейродегенеративных заболеваниях, таких как болезнь Паркинсона (БП) [3] и рассеянный склероз [4]. Однако исследований по БА немного. Доказано, что в слезной жидкости присутствует специфическая комбинация белков: повышение уровня дермицидина и снижение лактотрансферрина, пролактина, липокалина-1, лизоцима-С и лактритина с чувствительностью 81 % и специфичностью 77 % характерно для БА. Общее количество микро-РНК повышено в слезе пациентов с БА, при этом микро-РНК-200b-5p является наиболее
перспективным биомаркером для раннего выявления заболевания [5, 6]. В других работах продемонстрирован высокий уровень Aβ-42 и тау в слезе данной группы пациентов [7]. В 2021 году группой авторов из Тайваня были разработаны устройство для сбора слезы (рис. 1.IV) и биосенсор, который обнаруживает Aβ в образце слезы в концентрациях от 1 до 100 пг/мл [9]. В результате уровень Aβ в слезе был примерно в 10 раз выше, чем в образцах крови. В целом слезная жидкость может быть потенциальным биомаркером в диагностике БА, доступность и простота отбора проб делает ее перспективным источником молекулярных маркеров заболевания [7, 8, 9, 10].
Роговица – самая густо иннервированная ткань в организме человека [11]. Ее чувствительная иннервация осуществляется имеющими радиальное направление длинными цилиарными нервами (глазная ветвь тройничного нерва). Роговица содержит одну из самых высоких концентраций ацетилхолина (АЦХ), играющего ключевую роль в развитии и поддержании ее эпителия. При БА наблюдается дефицит АЦХ в ЦНС. Следовательно, изменения нервных волокон роговицы и эпителия могут развиваться одновременно с БА [11, 13]. Конфокальная микроскопия роговицы in vivo (англ. corneal confocal microscopy, ССМ, КМР) позволяет изучать ее строение на клеточном уровне. Она оказалась особенно полезной в качестве диагностического маркера для выявления диабетической и ряда других периферических невропатий [14, 15]. В зарубежной литературе есть несколько статей с небольшой выборкой пациентов, в которых при деменции использовалась КМР [12, 13, 16]. Нервные волокна роговицы при БА имеют морфологические особенности – специфическую длину, плотность волокон, плотность ветвей и дендритных клеток [12, 15]. G. Ponirakis et al. (2019) продемонстрировали на малой выборке уменьшение совокупной длины роговичных нервных волокон у пациентов с деменцией по сравнению с контрольной группой [16]. В более поздней работе (рис. 1.II) обследованы 66 пациентов, среди которых были пациенты с умеренными когнитивными нарушениями (УКН) и БА. Была показана высокая диагностическая точность данной методики, сопоставимая с оценкой атрофии медиальной височной доли (англ. medial temporal lobe atrophy score, МТА) при деменции и превосходящая по точности оценку МТА при УКН [13]. Таким образом, результаты имеющихся на сегодняшний день исследований роговицы при когнитивных нарушениях выглядят перспективными, однако они ограниченны и малочисленны по выборке пациентов, а сам метод инвазивен. Для вывода о возможности оценки роговицы в качестве биомаркера БА необходимы более тщательные исследования в этой области.
Зрачок. При БА возникает патологическая дегенерация ядра Эдингера – Вестфаля и базального ядра Мейнерта, что может быть связано с дефицитом АЦХ. Было показано, что при БА уменьшается латентность и амплитуда зрачкового рефлекса, увеличивается размер зрачка и наблюдается нетипичный ответ на холинергические антагонисты [17]. Обнаружена достоверная положительная корреляция между увеличением размера зрачка и концентрацией Aβ и тау в ЦСЖ. Однако пациенты из данного исследования были членами одной семьи с единой мутацией, поэтому полученные результаты могут быть неприменимы к другим спорадическим формам или вызванными мутацией в другом локусе. Кроме того, размер выборки был небольшим (всего 12 участников, разделенных на две равные группы), что снижает надежность результатов [18]. Необходимы дальнейшие исследования для оценки роли изменений зрачков при БА в качестве потенциального маркера БА и нейродегенерации в целом.
Хрусталик и внутриглазная жидкость. Хрусталик человека состоит из трех частей: капсулы, однослойного эпителия и клеток волокон. Волокна хрусталика представляют собой длинные, обычно прозрачные клетки. Как и при БА, при старении хрусталика человека увеличивается агрегация и накопление неправильных, нерастворимых белков [6, 19]. L. E. Goldstein et al. (2003) показали, что Aβ выявляется при аутопсии в образцах хрусталика у умерших с БА, и, кроме того, описали характерное отчетливое помутнение корковых слоев хрусталика у данных пациентов. Авторы пришли к выводу, что амилоид образуется в хрусталике самостоятельно, а не транспортируется из ЦНС [20]. J. A. Moncaster et al. (2010) обследовали пациентов с синдром Дауна (СД) [21] (рис. 1.III). В серии работ с 2012 по 2015 год в ходе изучения хрусталика была выявлена взаимосвязь в развитии кортикальной катаракты с изменением головного мозга при БА. Предположительно, причиной этого могут быть мутации в гене дельта-2-катенина, позже была показана статистически значимая разница в флуоресцентной сигнатуре благодаря использованию сканирующих методов и флуоресцентных лигандов [22–24]. Однако ряд исследователей не смогли идентифицировать в хрусталике отложение Aβ или других патологических маркеров, как и не выявили специфическое помутнение при катаракте у пациентов с БА [11, 25, 26]. Возможно, это связано с несоответствием техники окрашивания, использованием моноклональных антител с разными эпитопами, а также другой модальностью фиксации. Как можно заметить, полученные данные крайне противоречивы. Является ли хрусталик зеркальным отражением нейропатологических изменений мозга и накапливается ли Aβ в хрусталике при доклинической БА, еще предстоит выяснить.
Показано наличие Aβ-40 и Aβ-42 в водянистой влаге, а их уровни сопоставимы с уровнями в ЦСЖ [20, 27]. Несколько последующих исследований идентифицировали ассоциированные с БА патологические белки как в водянистой влаге, так и в стекловидном теле [8, 27]. L. M. Wright et al. (2019) одними из первых показали связь уровней Аβ и тау одновременно во внутриглазной жидкости и ЦСЖ со снижением когнитивных функций. Позднее они же выявили легкие цепи нейрофиламентов (НФЛ) в стекловидном теле и сообщили о положительной корреляции между уровнями НФЛ, Aβ-40, Aβ-42 и общим тау [28, 29].
Исследование внутриглазной жидкости и хрусталика в качестве маркера патологии БА представляет определенный интерес, однако выполнение биопсии для скрининга БА нецелесообразно, так как данная манипуляция инвазивна и требует вмешательства в операционной. Тем не менее есть возможность получить доступ к материалу от пациентов, перенесших операцию по удалению катаракты. Поскольку это обычная процедура, исследование данных нейроофтальмических маркеров для БА может быть более популярным. Кроме того, пациенты с катарактой и другими глазными заболеваниями, требующими хирургического вмешательства, подвергаются более высокому риску БА [30–32], поэтому выборочное обследование биоматериала во время операции может служить инструментом раннего скрининга для выявления и последующего наблюдения за данной группой риска.
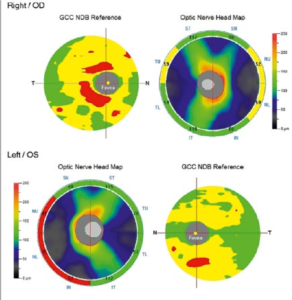
Сетчатка. Считается, что сетчатка является частью ЦНС и единственной доступной для прямой визуализации нервной тканью. У сетчатки и головного мозга множество общих характеристик, среди них общее онтогенетическое происхождение. Она содержит нейроны, астроглию, микроглию, микрососудистую сеть со сходными морфологическими и физиологическими свойствами и гематоэнцефалический барьер [23, 24, 33]. Из этого следует, что ее клетки могут погибать при нейродегенеративных заболеваниях. Сетчатка состоит из нескольких слоев клеток и может быть разделена на четыре сектора (верхний, нижний, височный и назальный) (рис. 1.I и 2). Одним из характерных признаков ранней стадии БА является нарушение зрения, которое может быть связано со структурными изменениями, такими как дегенерация зрительного нерва. Толщина слоя нервных волокон сетчатки (СНВС, англ. RNFL) в здоровом глазу составляет около 80 микрометров (мкм) [34] и определяется волокнами зрительного нерва, будучи наиболее толстой вблизи диска и постепенно уменьшаясь по направлению к периферии глазного дна. В связи с дегенерацией ганглиозных клеток (ГКС, англ. GCC) погибают их аксоны и истончается слой нервных волокон сетчатки [36]. С возрастом СНВС и другие структуры сетчатки естественным образом изменяются, что затрудняет вывод о том, связано истончение с нейродегенерацией либо со старением [35].
Известно, что образование патологических белков при БА начинается как минимум за полтора-два десятилетия до появления симптомов заболевания, однако общедоступная диагностика на доклиническом этапе пока отсутствует. В настоящее время достоверным методом диагностики является ПЭТ головного мозга с питсбургской субстанцией,
которая демонстрирует доклиническое накопление белка Aβ, однако этот метод является дорогостоящим и малодоступным. На данный момент ведется активный поиск методов скрининга для выявления ранней стадии БА и групп риска, через которые может пройти население в среднем возрасте (от 30 до 60 лет). Существуют перспективные методы сканирования сетчатки, позволяющие выявить признаки БА на самой ранней стадии до появления выраженного когнитивного дефицита. В качестве примера можно привести конфокальную сканирующую лазерную офтальмоскопию (СЛО) и оптическую когерентную томографию (ОКТ). Визуализация сетчатки in vivo, возможно, обеспечит простой и неинвазивный способ фиксации патологических изменений в головном мозге.
Наличие белковых агрегатов в сетчатке может быть использовано для выявления доклинической стадии БА. Aβ-бляшки и тау-клубки были обнаружены в слое ганглиозных клеток трансгенных мышей с БА на преклинической стадии, что значительно ускоряло прогрессирование заболевания [37]. Впервые Aβ-бляшки в сетчатке глаза человека были описаны Koronyo – Hamaoui at al. (2011) по результатам аутопсии умерших с БА. В этом исследовании использовалась визуализация бляшек Aβ с помощью куркумина, который связывается с ними и флуоресцирует, позволяя также визуализировать сетчатку in vivo [38]. Авторы предположили, что накопление Аβ в сетчатке возникает раньше, чем в головном мозге. Аβ-бляшки в сетчатке качественно соответствовали церебральным, а это резко контрастировало с минимальным обнаружением Aβ у здоровых людей того же возраста. Однако в настоящее время точно неизвестно, насколько специфично куркумин связывается с бляшками Aβ [37], например, он связывался с целым рядом белков, в том числе с α-синуклеином при БП [39]. Было отмечено, что различные формы куркумина и куркуминоиды имеют разное сродство с бляшками Aβ. Важно отметить, что куркумин не связывается с неагрегированным Aβ у лиц без БА [40].
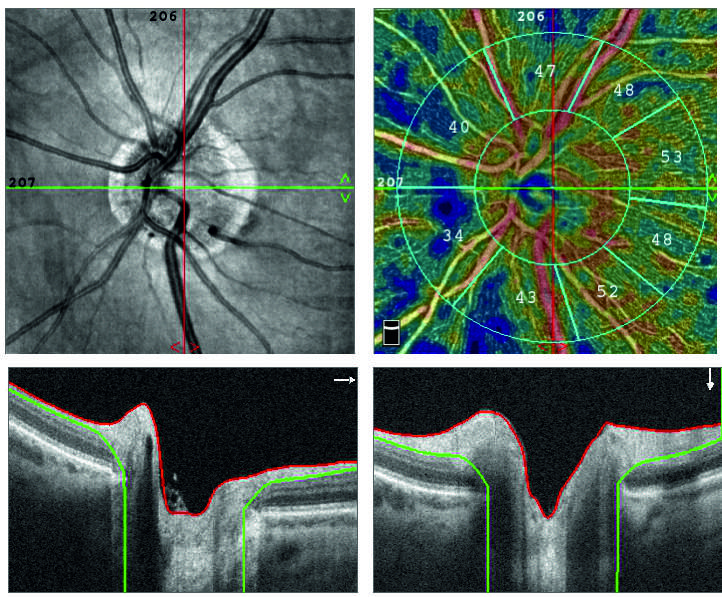
Оптическая когерентная томография (ОКТ) используется для оценки структуры сетчатки и представляет собой инфракрасный интерферометр, на объектном плече которого находится исследуемая ткань, а на опорном плече – референсное зеркало (рис. 2). В одном исследовании СНВС и СГК, измеренные с помощью спектрально-доменной OКT у пациентов с болезнью Альцгеймера, были значительно тоньше, чем в контрольной группе [41]. Позднее другие авторы также описали, что средняя толщина СНВС значительно меньше у пациентов с БА по сравнению с пациентами с УКН [35, 41]. В исследовании J. P. Cunha et al. (2017) использовался тот же метод для сравнения толщины перипапиллярного слоя нервных волокон сетчатки с общей ее толщиной у пациентов с БА. Установлено, что СНВС был значительно уменьшен в группе пациентов с БА в верхнем височном квадранте [42]. S. Kirbas et al. (2013) обнаружили, что истончение СНВС происходит избирательно в верхнем квадранте при БА (76 ± 6,7 мкм) по сравнению с группой контроля (105 ± 4,8 мкм; p = 0,001). В остальных трех квадрантах существенной разницы в толщине СНВС не наблюдалось [45]. D. Liu et al. сравнили толщину СНВС у лиц с УКН и различной тяжестью БА (легкой, умеренной и тяжелой) и обнаружили значительную разницу между всеми группами в верхнем и нижнем квадрантах, но не в назальном или височном [46]. В первом продольном исследовании лиц с БА на доклинической стадии было обнаружено значительное уменьшение объема макулярной СНВС через несколько лет по сравнению с контрольной группой, а значит, истончение макулярного слоя нервных волокон сетчатки может быть самым ранним маркером доклинической БА [47]. В другом исследовании у пациентов с доклинической БА (Aβ+, по данным ПЭТ) оценка толщины СНВС с помощью спектрально-доменной ОКТ не показала существенных различий с изображениями здоровых людей [43]. В нескольких исследованиях продемонстрировано, что истончение СНВС недостаточно для отличия БА от здоровых лиц [40, 43, 44]. Метаанализ показал, что толщина сетчатки снижается при БА и УКН по сравнению с группой контроля, что еще раз подтверждает, что изменения сетчатки могут отражать нейродегенеративные изменения [40]. Недавно появились данные о новом высокочувствительном тесте визуализации – поляризационно-чувствительной ОКТ, которая может обнаружить двулучепреломление, вызванное повреждением микротрубочек, связанное с БА. Этот метод выглядит перспективным, поскольку двулучепреломление появляется до уменьшения толщины СНВС согласно полученным данным [48]. Позже метод был протестирован на людях, что показало его перспективность в качестве биомаркера ранней стадии БА [49]. В целом истончение СНВС удовлетворяет всем критериям биомаркера для первичной диагностики неврологических заболеваний, включая БА, деменцию с тельцами Леви, БП, рассеянный склероз и др. [50]. Однако до сих пор не было проведено исчерпывающего исследования того, можно ли окончательно дифференцировать какое-либо нейродегенеративное заболевание, основываясь только на местоположении и степени истончения сетчатки. Различные аппараты для ОКТ имеют разные методы сегментации, осевое разрешение, площадь сканирования и протоколы визуализации. Это может влиять на качество полученного изображения и значительно изменять результат полученной толщины нервного слоя сетчатки [40, 50]. Заболевания глаз, такие как глаукома, также могут привести к истончению СНВС. Это является еще одной проблемой в дополнение к сложности дифференциации между несколькими нейродегенеративными заболеваниями, поскольку СНВС может быть снижена при всех из них. На сегодняшний день для постановки точного диагноза измерение толщины сетчатки должно использоваться в сочетании с другими диагностическими тестами, несмотря на большой потенциал этого метода.
Учитывая относительную сложность сосудистой сети сетчатки, потребовались более тонкие методы визуализации. В настоящее время набирает популярность использование ОКТ-ангиографии (ОКТА) для выделения специфических сосудистых сплетений у пациентов с БА [43, 51, 52, 53]. OКT-ангиография – это относительно новая технология, которая предоставляет информацию о ретинохориоидальном микроциркуляторном русле неинвазивным способом. Это дополнительное программное усовершенствование к коммерчески доступной ОКТ предоставляет дополнительную информацию о сосудах, аналогичную той, которую можно получить с помощью ангиограммы, но без использования инвазивного красителя для внутривенного введения. Потеря перицитов является одним из признаков разрушения гематоэнцефалического барьера при нейродегенерации, однако эта область не является хорошо изученной. В одном из исследований с достаточным размером выборки (56 образцов сетчатки умерших с БА) были количественно определены Aβ-42 и Aβ-40 в кровеносных сосудах сетчатки пациентов с БА, которые были связаны с рецептором тромбоцитарного фактора роста b. Было обнаружено отложение Aβ в микрососудах сетчатки и перицитах, сопровождающееся значительной потерей последних [54]. Сосудистая плотность сетчатки снижена у пациентов с БА и недементными когнитивными нарушениями (рис. 3). Так, в исследовании S. P. Yoon (2019) была получена самая большая выборка изображений от пациентов с БА и УКН для сравнения с контролем, при этом все пациенты были примерно одного возраста. Было установлено, что перфузия и плотность макулярных сосудов у пациентов с БА значительно снижены по сравнению с контролем и лицами с УКН [51, 52]. В исследовании с участием девяти человек с БА различной степени выраженности было обнаружено уменьшение на 11,2 % диаметра венозного столба главной височной вены сетчатки по сравнению с контрольной группой [55]. В более поздней работе продемонстрировано, что венозный кровоток сетчатки в группе пациентов с БА снизился на 38,6 %, а диаметр венозного кровеносного столба уменьшился на 13,3 % [56]. Помимо сужения сосудов сетчатки, вызывающего снижение кровотока, M. A. Williams et al. (2015) доказали, что при альцгеймеровской патологии чаще наблюдаются изменения микрососудов сетчатки, что приводит к обеднению микрососудистой сети и может быть зеркальным отражением изменений, происходящих в головном мозге [57].
В целом эти исследования позволяют предположить, что сосудистая сеть сетчатки может быть использована в качестве глазного биомаркера наряду с текущей диагностикой БА для оценки доклинической стадии.
Исследование офтальмологических маркеров БА в Российской Федерации
В России активно ведутся исследования офтальмологических маркеров нейродегенерации на передовом уровне. За последние годы проведено несколько крупных работ, посвященных данной области, с применением современных методов визуализации. В. П. Еричев и соавт. (2014) выполняли оценку морфометрических параметров сетчатки и диска зрительного нерва с помощью ОКТ. Ими установлено, что при БА происходит диффузное истончение сетчатки и увеличение параметра уровня глобальных потерь комплекса ГКС в сравнении с когнитивно сохранными пациентами [58]. Ими же в 2015 году пациентам с БА, глаукомой и контрольной группе выполнялось исследование мультифокальных зрительных вызванных потенциалов (мФ-ЗВП) и ОКТ. При БА авторами описано значительное увеличение латентности мф-ЗВП при отсутствии выраженных изменений на сетчатке и зрительном нерве, что говорит о более проксимальном уровне поражения зрительного пути при данной патологии. Также проводился иммуногистохимический анализ аутопсийного материала наружного коленчатого тела на тау-белок и Аβ одного пациента с глаукомой и двух пациентов с болезнью Альцгеймера. Данные маркеры нейродегенерации были обнаружены при обеих патологиях [59].
В работе 2018 года с применением спектрального ОКТ участниками нашей исследовательской группы проведена обработка данных 15 исследуемых (10 человек с БА, 2 – со смешанной энцефалопатией и УКН, 3 – в группе контроля). При БА толщина СГК в фовеолярной области соответствовала низкому баллу по шкале MMSE (r = 0,74; p < 0,05), что может говорить о связи выраженности клинических проявлений БА и уменьшения толщины сетчатки в фовеолярной области [60]. Е. В. Махнович (2019) было установлено, что у пациентов с БА и глаукомой после проведения ОКТ изменения сетчатки выявляются в перифовеальной области в верхнем и нижнем квадрантах, а при СД – в фовеальной (центральной) области сетчатки, что несколько разнится с данными предыдущих исследований. Также у больных с БА была выявлена связь более низкого балла при нейропсихологическом тестировании со сниженной толщиной перипапиллярного СНВС в височной и перифовеальной областях верхнего и нижнего квадрантов сетчатки, СГК и внутреннего плексиформного слоя [61].
Р. Н. Гулиева (2020) обнаружила, что средняя толщина СНВС у пациентов с БА была ниже на 27,0 % в височном, верхнем и нижнем квадрантах и на 15,4 % – в носовом квадранте. При анализе толщины СГК средняя толщина, толщина в верхнем и нижнем сегментах СГК у пациентов с БА оказались сниженными, однако статистически значимой разницы между показателями обеих групп не отмечалось, но выявлено статистически значимое повышение индексов фокальных и глобальных потерь СГК [62].
Из вышеизложенного следует, что основным методом для поиска офтальмологических маркеров нейродегенерации, в частности БА, в России является ОКТ. Данный метод обследования является неинвазивным, безопасным для пациента и все более доступным в нашей стране. Однако существующие литературные данные не всегда совпадают среди исследователей. Например, нет единого мнения, в какой именно области происходит истончение слоя нервных волокон сетчатки, хотя большая часть ученых, как и зарубежные коллеги, описывают поражение в верхнем височном квадранте. Перспективным является освоение других методик исследования, таких как сканирующая лазерная офтальмоскопия с применением флюоресцирующих, тропных к амилоиду лигандов. Исследования других элементов глаза, таких как хрусталик и роговица, также малочисленны в нашей стране и остаются крайне перспективными.
Заключение
Исследования нейроофтальмологических маркеров для ранней диагностики БА являются многообещающими. Некоторые из них, например хрусталик, доступны в качестве материала для скрининга во время реклинации катаракты, хотя их диагностическая способность остается малоизученной и достаточно спорной. Совсем недавно были обнаружены Aβ, тау, и НФЛ во внутриглазной жидкости у пациентов с когнитивными нарушениями амнестического типа, но необходимы дополнительные исследования, чтобы воспроизвести эти результаты и уточнить, какую роль они могут играть в раннем выявлении БА. Аналогичным образом неинвазивная визуализация сетчатки глаза с помощью ОКТ, СЛО и ОКТА показали перспективные результаты. В будущем может быть рассмотрен комбинированный подход с использованием офтальмологических маркеров, включающий неинвазивную визуализацию сетчатки и обнаружение патологических белков во внутриглазной жидкости, хрусталике или сетчатке. Это сочетание, возможно, станет аналогом системы классификации ATN [1] для БА в виде сочетания визуализации с помощью МРТ- или ПЭТ-сканирования и обнаружения белков в ЦСЖ. Следовательно, необходимо провести больше исследований в этой области, особенно продольных, позволяющих проследить изменения офтальмологических маркеров у пациентов по мере нарастания когнитивного дефицита. В будущем совершенствование методов обследования и более крупные исследования дополнят существующие данные о том, как нейроофтальмологические маркеры изменяются уникальным образом при деменции альцгеймеровского типа. Это поможет выявить ключевые закономерности, обнаружить новые биомаркеры для ранней диагностики БА и, возможно, разработать новые способы лечения данного заболевания. Исследования в данной области остаются актуальными в наше время.
Список литературы / References
- Jack C. R. et al. A/T/N: An unbiased descriptive classification scheme for Alzheimer disease biomarkers. Neurology. 2016; 87 (5): 539–47. DOI: 10.1212/WNL.0000000000002923.
- Wagner S. K., Fu D. J., Faes L. et al. Insights into Systemic Disease through Retinal Imaging-Based Oculomics [published correction appears in Transl Vis Sci Technol. Transl Vis Sci Technol. 2020; 9 (2): 6. DOI: 10.1167/tvst.9.2.6.
- Boerger M., Funke S., Leha A., et al. Proteomic analysis of tear fluid reveals disease-specific patterns in patients with Parkinson’s disease – A pilot study. Parkinsonism Relat Disord. 2019; 63: 3–9. DOI: 10.1016/j.parkreldis.2019.03.001.
- Pieragostino D., Lanuti P., Cicalini.I, et al. Proteomics characterization of extracellular vesicles sorted by flow cytometry reveals a disease-specific molecular cross-talk from cerebrospinal fluid and tears in multiple sclerosis. J Proteomics. 2019; 204: 103403. DOI:
10.1016/j.jprot.2019.103403.
- Kenny A. Proteins and microRNAs are differentially expressed in tear fluid from patients with Alzheimer’s disease. Scientific reports. 2019; 9 (1). 15437. DOI: 10.1038/ s41598–019–51837-y.
- Moreau K. L., King J. A. Protein misfolding and aggregation in cataract disease and prospects for prevention. Trends Mol Med. 2012; 18 (5): 273–282. DOI: 10.1016/j. molmed.2012.03.005.
- Gijs M., Nuijts R. M., Ramakers I. et al. Differences in tear protein biomarkers between patients with Alzheimer’s disease and controls. Investig. Ophthalmol. 2019; 60 (9): 1744.
- Lim JK, Li QX, He Z et al. The Eye as a Biomarker for Alzheimer’s Disease. Front Neurosci. 2016; 10: 536. DOI: 10.3389/fnins.2016.00536.
- Wang Y.-R. et al. High-Sensitivity and Trace-Amount Specimen Electrochemical Sensors for Exploring the Levels of β-Amyloid in Human Blood and Tears. Analytical chemistry. 2021; 93 (22): 8099–8106. DOI: 10.1021/acs.analchem.0c04980.
- Karki H. P. et al. Advances in the development paradigm of biosample-based biosensors for early ultrasensitive detection of Alzheimer’s disease. Journal of nanobiotechnology. 2021. 19 (1): 72. DOI: 10.1186/s12951–021–00814–7.
- Dehghani C. et al. Ocular Biomarkers of Alzheimer’s Disease: The Role of Anterior Eye and Potential Future Directions. Investigative ophthalmology & visual science. 2018. 59 (8): 3554–3563. DOI: 10.1167/iovs.18–24694.
- Dehghani C. et al. Morphometric Changes to Corneal Dendritic Cells in Individuals with Mild Cognitive Impairment. Frontiers in neuroscience. 2020; 14: 556137. DOI: 10.3389/ fnins.2020.556137.
- Al-Janahi E. et al. Corneal Nerve and Brain Imaging in Mild Cognitive Impairment and Dementia. Journal of Alzheimer’s disease. 2020. 77 (4): 1533–1543. DOI: 10.3233/JAD-200678.
- Tavakoli M. et al. Corneal confocal microscopy: a novel non-invasive test to diagnose and stratify the severity of human diabetic neuropathy. Diabetes care. 2010; 33 (8): 1792–1797. DOI: 10.2337/dc10–0253.
- Campagnolo M. et al. Corneal confocal microscopy in patients with oxaliplatin-induced peripheral neuropathy. Journal of the peripheral nervous system: JPNS Vol. 18, 3 (2013): 269–71. DOI: 10.1111/jns5.12036.
- Ponirakis G. et al. Association of corneal nerve fiber measures with cognitive function in dementia. Annals of clinical and translational neurology Vol. 6, 4. 689–697. 2 Mar. 2019, DOI: 10.1002/acn3.746.
- Singh A. K., Shilpa V. Use of ocular biomarkers as a potential tool for early diagnosis of Alzheimer’s disease. Indian journal of ophthalmology Vol. 68, 4 (2020): 555–561. DOI: 10.4103/ijo.IJO_999_19.
- Frost S. M. et al. Pupil response biomarkers distinguish amyloid precursor protein mutation carriers from non-carriers. Current Alzheimer research Vol. 10, 8 (2013): 790–6. DOI: 10.2174/15672050113109990154.
- Forrester J. V., Dick A. D., McMenamin P.G. et al. The Eye: Basic Sciences in Practice, 2016.
- Goldstein L. E. et al. Cytosolic beta-amyloid deposition and supranuclear cataracts in lenses from people with Alzheimer’s disease. Lancet (London, England) Vol. 361, 9365 (2003): 1258–65. DOI: 10.1016/S 0140–6736 (03)12981–9.
- Moncaster J. A. et al. Alzheimer’s disease amyloid-beta links lens and brain pathology in Down syndrome. PloS one Vol. 5, 5 e10659. 20 May. 2010, DOI: 10.1371/journal. pone.0010659.
- Jun G. et al. δ-Catenin is genetically and biologically associated with cortical cataract and future Alzheimer-related structural and functional brain changes. PloS one vol. 7, 9 (2012): e43728. DOI: 10.1371/journal.pone.0043728.
- Kerbage C. et al. Alzheimer’s disease diagnosis by detecting exogenous fluorescent signal of ligand bound to Beta amyloid in the lens of human eye: an exploratory study. Frontiers in Neurology Vol. 4, 62. 27 May. 2013, DOI: 10.3389/fneur.2013.00062.
- Kerbage C. et al. Detection of Amyloid β Signature in the Lens and Its Correlation in the Brain to Aid in the Diagnosis of Alzheimer’s Disease. American Journal of Alzheimer’s disease and other dementias Vol. 30, 8 (2015): 738–45. DOI: 10.1177/1533317513520214.
- Michael R. Absence of amyloid-beta in lenses of Alzheimer patients: a confocal Raman microspectroscopic study. Experimental Eye Research Vol. 119 (2014): 44–53. DOI: 10.1016/j.exer.2013.11.016.
- Williams E. A. et al. Absence of Alzheimer Disease Neuropathologic Changes in Eyes of Subjects with Alzheimer Disease. Journal of neuropathology and experimental neurology Vol. 76, 5 (2017): 376–383. DOI: 10.1093/jnen/nlx020.
- Yu T. C., Okamura R. Quantitative study of characteristic aqueous humor transferrin, serum transferrin and desialized serum transferrin in aqueous humor. Japanese Journal of Ophthalmology Vol. 32, 3 (1988): 268–74.
- Wright L. M. et al. Association of Cognitive Function with Amyloid-β and Tau Proteins in the Vitreous Humor. Journal of Alzheimer’s Disease: JAD Vol. 68, 4 (2019): 1429–1438. DOI: 10.3233/JAD-181104.
- Subramanian M. L. et al. Neurofilament light chain in the vitreous humor of the eye. Alzheimer’s Research & Therapy Vol. 12, 1 111. 17 Sep. 2020, DOI: 10.1186/s13195–020–00677–4. 30. Lee C. S. et al. Associations between recent and established ophthalmic conditions and risk of Alzheimer’s disease. Alzheimer’s & dementia: the Journal of the Alzheimer’s Association Vol. 15, 1 (2019): 34–41. DOI: 10.1016/j.jalz.2018.06.2856.
- Lee C. S. et al. Ophthalmology-Based Neuropathology Risk Factors: Diabetic Retinopathy is Associated with Deep Microinfarcts in a Community-Based Autopsy Study. Journal of Alzheimer’s disease: JAD Vol. 68, 2 (2019): 647–655. DOI: 10.3233/JAD-181087.
- Xiao-He H. et al. Association between glaucoma and the risk of Alzheimer’s disease: A systematic review of observational studies. Acta Ophthalmologica Vol. 97, 7 (2019): 665–671. DOI: 10.1111/aos.14114.
- Ledig C. et al. Structural brain imaging in Alzheimer’s disease and mild cognitive impairment: biomarker analysis and shared morphometry database. Scientific reports Vol. 8,1 11258. 26 Jul. 2018, DOI: 10.1038/s41598–018–29295–9.
- Budenz D. L. et al. Determinants of normal retinal nerve fiber layer thickness measured by Stratus OCT. Ophthalmology Vol. 114, 6 (2007): 1046–52. DOI: 10.1016/j. ophtha.2006.08.046.
- Kwon J. Y. et al. Analysis of the Retinal Nerve Fiber Layer Thickness in Alzheimer Disease and Mild Cognitive Impairment. Korean Journal of Ophthalmology: KJO Vol. 31, 6 (2017): 548–556. DOI: 10.3341/kjo.2016.0118.
- Doustar J. et al. Optical Coherence Tomography in Alzheimer’s Disease and Other Neurodegenerative Diseases. Frontiers in neurology Vol. 8 701. 19 Dec. 2017, DOI: 10.3389/fneur.2017.00701.
- Grimaldi A. et al. Inflammation, neurodegeneration and protein aggregation in the retina as ocular biomarkers for Alzheimer’s disease in the 3xTg-AD mouse model. Cell Death & Disease Vol. 9, 6 685. 7 Jun. 2018, DOI: 10.1038/s41419–018–0740–5.
- Koronyo-Hamaoui M. et al. “Identification of amyloid plaques in retinas from Alzheimer’s patients and non-invasive in vivo optical imaging of retinal plaques in a mouse model.” Neuro Image Vol. 54 Suppl 1 (2011): S 204–17. DOI: 10.1016/j.neuroimage.2010.06.020.
- Jha N. N. et al. Effect of curcumin analogs onα-synuclein aggregation and cytotoxicity. Scientific Reports Vol. 6 28511. 24 Jun. 2016, DOI: 10.1038/srep28511.
- den Haan J. et al. Different curcumin forms selectively bind fibrillar amyloid beta in post mortem Alzheimer’s disease brains: Implications for in-vivo diagnostics. Acta Neuropathologica Communications Vol. 6, 1 75. 9 Aug.
- Asanad S. et al. The Retina in Alzheimer’s Disease: Histomorphometric Analysis of an Ophthalmologic Biomarker. Investigative Ophthalmology & Visual Science Vol. 60, 5 (2019): 1491–1500. DOI: 10.1167/iovs.18–25966.
- Cunha J. P. et al. OCT in Alzheimer’s disease: thinning of the RNFL and superior hemiretina. Graefe’s archive for clinical and experimental ophthalmology = Albrecht von Graefes Archiv fur klinische und experimentelle Ophthalmologie vol. 255, 9 (2017): 1827–1835. DOI: 10.1007/s00417–017–3715–9.
- van de Kreeke J. A. et al. “Optical coherence tomography angiography in preclinical Alzheimer’s disease.” The British Journal of Ophthalmology Vol. 104, 2 (2020): 157–161. DOI: 10.1136/bjophthalmol-2019–314127.
- Zabel P. et al. Peripapillary Retinal Nerve Fiber Layer Thickness in Patients with Alzheimer’s Disease: A Comparison of Eyes of Patients with Alzheimer’s Disease, Primary Open-Angle Glaucoma, and Preperimetric Glaucoma and Healthy Controls.” Medical science monitor: International Medical Journal of Experimental and Clinical Research Vol. 25 1001–1008. 5 Feb. 2019, DOI: 10.12659/MSM.914889.
- Kirbas S. et al. Retinal nerve fiber layer thickness in patients with Alzheimer disease. Journal of Neuro-Ophthalmology: The Official Journal of the North American Neuro-Ophthalmology Society Vol. 33, 1 (2013): 58–61. DOI: 10.1097/WNO.0b013e318267fd5f.
- Liu D., Zhang L., Li Z. et al. (2015). Thinner changes of the retinal nerve fiber layer in patients with mild cognitive impairment and Alzheimer’s disease. BMC Neurol. 15, 1–5. DOI: 10.1186/s12883–015–0268–6.
- Santos Cláudia Y. et al. “Change in retinal structural anatomy during the preclinical stage of Alzheimer’s disease.” Alzheimer’s & Dementia (Amsterdam, Netherlands) Vol. 10 196–209. 7 Feb. 2018, DOI: 10.1016/j.dadm.2018.01.003.
- Martins R. N. et al. Alzheimer’s Disease: A Journey from Amyloid Peptides and Oxidative Stress, to Biomarker Technologies and Disease Prevention Strategies-Gains from AIBL and DIAN Cohort Studies.” Journal of Alzheimer’s Disease: JAD Vol. 62, 3 (2018): 965–992. DOI: 10.3233/JAD-171145.
- Colligris P. et al. Ocular Manifestations of Alzheimer’s and Other Neurodegenerative Diseases: The Prospect of the Eye as a Tool for the Early Diagnosis of Alzheimer’s Disease. Journal of Ophthalmology Vol. 2018 8538573. 30 Jul. 2018, DOI: 10.1155/2018/8538573.
- Sánchez D. et al. Usefulness of peripapillary nerve fiber layer thickness assessed by optical coherence tomography as a biomarker for Alzheimer’s disease. Scientific Reports Vol. 8, 1 16345. 5 Nov. 2018, DOI: 10.1038/s41598–018–34577–3.
- Yoon S. P. et al. Retinal Microvascular and Neurodegenerative Changes in Alzheimer’s Disease and Mild Cognitive Impairment Compared with Control Participants. Ophthalmology. Retina Vol. 3, 6 (2019): 489–499. DOI: 10.1016/j.oret.2019.02.002.
- Yoon S. P. et al. Correlation of OCTA and Volumetric MRI in Mild Cognitive Impairment and Alzheimer’s Disease. Ophthalmic Surgery, Lasers & Imaging Retina Vol. 50, 11 (2019): 709–718. DOI: 10.3928/23258160–20191031–06.
- Querques G. et al. Functional and morphological changes of the retinal vessels in Alzheimer’s disease and mild cognitive impairment. Scientific Reports Vol. 9, 1 63. 11 Jan. 2019, DOI: 10.1038/s41598–018–37271–6.
- Shi H. et al. Identification of early pericyte loss and vascular amyloidosis in Alzheimer’s disease retina. Acta Neuropathologica Vol. 139, 5 (2020): 813–836. DOI: 10.1007/ s00401–020–02134-w.
Berisha F. et al. Retinal abnormalities in early Alzheimer’s disease. Investigative Ophthalmology & Visual Science Vol. 48, 5 (2007): 2285–9. DOI: 10.1167/iovs.06–1029.
- Feke G. T. et al. Retinal blood flow in mild cognitive impairment and Alzheimer’s disease. Alzheimer’s & Dementia (Amsterdam, Netherlands) vol. 1, 2 144–51. 23 Apr. 2015, DOI:
10.1016/j.dadm.2015.01.004.
- Williams M. A. et al. Retinal microvascular network attenuation in Alzheimer’s disease. Alzheimer’s & Dementia (Amsterdam, Netherlands) vol. 1, 2 229–235. 16 May. 2015, DOI: 10.1016/j.dadm.2015.04.001.
- Еричев В. П., Панюшкина Л. А. Диагностическая ценность функциональных и морфометрических параметров сетчатки и зрительного нерва у пациентов с болезнью Альцгеймера. Национальный журнал Глаукома. 2014; 13 (2): 5–10. Erichev V. P., Panyushkina L. A. Diagnostic value of functional and morphometric parameters of retina and optic nerve in patients with Alzheimer’s disease. National Journal of Glaucoma. 2014; 13 (2): 5–10.
- Еричев В. П., Панюшкина Л. А., Туманов В. П. Глаукома и болезнь Альцгеймера: функционально-структурные и морфологические особенности. X Съезд офтальмологов России. Сборник научных материалов. Москва, 17–19 июня 2015 г. Erichev V. P., Panyushkina L. A., Tumanov V. P. Glaucoma and Alzheimer’s disease: functional-structural and morphological features. X Congress of ophthalmologists of Russia. Collection of scientific materials. Moscow, June 17–19, 2015.
- Киливаева Г. А., Лобзин В. Ю., Емелин А. Ю., Мальцев Д. С. Оптическая когерентная томография сетчатки при болезни Альцгеймера. Вестник Российской Военномедицинской академии. 2018; 20 (3S): 141–141. Kilivaeva G. A., Lobzin V. Yu., Emelin A. Yu., Maltsev D. S. Optic coherent tomography of retina in Alzheimer’s disease. Bulletin of the Russian Military Medical Academy. 2018; 20 (3S): 141–141.
- Махнович Е. В. автореф. Взаимосвязь когнитивных нарушений и изменений нейроархитектоники сетчатки. дисc. канд. наук. – Москва: 2019; 23 с. Makhnovich EV. Abstract: Interrelation of cognitive disorders and changes in retinal neuroarchitectonics. Ph D. thesis – Moscow: 2019; 23 p.
- Гулиева Р. Н. Изменения сетчатки при болезни Альцгеймера. Вестник офтальмологии. 2020; 136 (3): 74–78. DOI: 10.17116/oftalma202013603174. Gulieva R. N. Retinal changes in Alzheimer’s disease. Bulletin of Ophthalmology. 2020; 136 (3): 74–78. DOI: 10.17116/oftalma202013603174.
Сведения об авторах
Лобзин Владимир Юрьевич, д. м. н., проф., проф. кафедры неврологии имени акад. С. Н. Давиденкова1, с. н. с. отдела нейроинфекций и органической
патологии нервной системы2, проф. кафедры нервных болезней3. E-mail: vladimirlobzin@mail.ru. ORCID: 0000–0003–3109–8795
Мальцев Дмитрий Сергеевич, д. м. н., доцент, доцент кафедры офтальмологии, зав. лазерным отделением клиники офтальмологии3. E—mail: glaz.med@yandex.ru. ORCID: 0000–0001–6598–3982
Струментова Елена Сергеевна, врач-невролог клиники, аспирант кафедры неврологии имени акад. С. Н. Давиденкова1. E—mail: lenavmeda@mail.ru.
ORCID: 0000–0002–2867–1223
Бурнашева Мария Андреевна, врач-офтальмолог клиники офтальмологии3. E—mail: maria.andreevna1@gmail.com. ORCID: 0000–0001–7384–2223
Черемисин Сергей Сергеевич, ординатор-невролог кафедры неврологии имени акад. С. Н. Давиденкова1. E—mail: cheremisin_sergey@mail.ru. ORCID: 0000–0001–7685–5257
1ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И. И. Мечникова» Минздрава России, Санкт-Петербург
2ФГБУ «Детский научно-клинический центр инфекционных болезней» ФМБА России, Санкт-Петербург
3ФГБВОУ ВО «Военно-медицинская академия имени С. М. Кирова» Минобороны России, Санкт-Петербург
Автор для переписки: Струментова Елена Сергеевна. E-mail: lenavmeda@mail.ru
About authors
Lobzin Vladimir Yu., DM Sci (habil.), professor, professor at Dept of Neurology
- a. acad. S. N. Davidenkov1, senior researcher at Dept of Neuroinfections and Organic Pathology of Nervous System2, professor at Dept of Nervous Diseases3. E-mail: vladimirlobzin@mail.ru. ORCID: 0000–0003–3109–8795
Maltsev Dmitrii S., DM Sci (habil.), assistant professor, assistant professor at Ophthalmology Dept, head of Laser Dept of Ophthalmology Clinic3. E-mail: glaz.med@yandex.ru. ORCID: 0000–0001–6598–3982
Strumentova Elena S., neurologist, 1st year postgraduate student of Dept of Neurology n. a. acad. S. N. Davidenkov1. E-mail: lenavmeda@mail.ru.
ORCID: 0000–0002–2867–1223
Burnasheva Maria A., ophthalmologist of Ophthalmology Dept3.
E-mail: maria.andreevna1@gmail.com. ORCID: 0000–0001–7384–2223
Cheremisin Sergey S., 1st year resident of Dept of Neurology n. a. acad. S. N. Davidenkov1. E-mail: cheremisin_sergey@mail.ru. ORCID: 0000–0001–7685–5257
1North-Western State Medical University n. a. I. I. Mechnikov, Saint Petersburg, Russia
2Children’s Research and Clinical Centre for Infectious Diseases, Saint Petersburg, Russia
3Military Medical Academy n. a. S. M. Kirov, Saint Petersburg, Russia
Corresponding author: Strumentova Elena S. E-mail: lenavmeda@mail.ru
Для цитирования: Лобзин В. Ю., Мальцев Д. С., Струментова Е. С., Бурнашева М. А., Черемисин С. С. Офтальмологические маркеры болезни Альцгеймера. Медицинский алфавит. 2022; (1): 47–53. https://doi.org/10.33667/2078-5631-2022-1-47-53 | For citation: Lobzin V. Yu., Maltsev D. S., Strumentova E. S., Burnasheva M. A., Cheremisin S. S. Ophthalmological markers of Alzheimer’s disease. Medical alphabet. 2022; (1): 47–53. https://doi.org/10.33667/2078-5631-2022-1-47-53 |

