Н.В. Бакулина1 д.м.н. профессор
С.В. Тихонов1 к.м.н. доцент
C.А. Винчук1 к.м.н. доцент
В.Д. Декканова1 старший лаборант
1 – Кафедра внутренних болезней клинической фармакологии и нефрологии «Северо-Западный государственный медицинский университет И.И.Мечникова» Министерства здравоохранения Российской Федарации, г.Санкт-Петербург.
ВВЕДЕНИЕ.
В 2019 г. в городе Ухань Китайской народной республики впервые зафиксирована вспышка тяжелой пневмонии, неясного генеза с высокой контагиозностью и летальностью. 30 января 2020 г. ВОЗ объявила эту вспышку чрезвычайно опасной ситуацией для общественного здоровья, имеющей международное значение. 11 февраля 2020 г. новое заболевание получило официальное название – инфекция, вызванная новым коронавирусом – COVID-19 (CоronaVirus Disease 2019). Международный комитет по таксономии вирусов присвоил возбудителю инфекции официальное название SARS-CoV-2 [1-2].
11 марта 2020 года была объявлена пандемия новой коронавирусной инфекции COVID-19 [2]. В Российской Федерации по данным Росстата, опубликованным 7 августа, за период с апреля по июнь непосредственно от COVID-19 умерло 16 388 человек, смерть 3 443 пациентов наступила от других заболеваний, декомпенсированных на фоне данной инфекции [3].
В популяции круглогодично присутствуют четыре сезонных коронавируса – HCoV-229E, -OC43, -NL63 и — HKU1, вызывающих поражение верхних дыхательных путей легкой и средней степени тяжести. Два типа коронавируса являются высокопатогенными, приводящими к летальным исходам – это новый SARS-CоV-2 и MERS-CoV – вирус ближневосточного респираторного синдрома (MERS) [4].
Впервые коронавирус стал причиной развития эпидемии в 2002 году. Почти по всем странам мира прокатилась волна атипичной пневмонии, вызванная коронавирусом SARS-CоV. Эпидемия длилась в течение 2-х лет с 2002 по 2004 гг. В 2012 году на Аравийском полуострове произошла еще одна вспышка инфекции, причиной которой являлся MERS-CoV. В отличие от SARS-CоV MERS-CoV продолжает циркулировать в популяции и вызывать новые случаи заболевания [4].
Основной путь взаимодействия SARS-CoV и SARS-CoV-2 с клетками человека опосредуется рецепторами к ангиотензин превращающему ферменту 2 (АСЕ2), что было подтверждено исследованиями китайских ученых во время эпидемии атипичной пневмонии и в недавних работах по изучению COVID-19 [5]. MERS-CoV для входа в клетки хозяина использует дипептидилпептидазу-4 [6].
Факторами, ухудшающими течение коронавирусной инфекции, являются ожирение, артериальная гипертензия, сахарный диабет [7-9]. Таким образом именно ожирение и ассоциированные с ним заболевания, входящие в структуру метаболического синдрома, определяют характер течения данной инфекции. Пациенты с ожирением и НАЖБП имеют 6-кратное повышение риска тяжелого и очень тяжелого течения COVID-19[10].
Ожирение является крупнейшей неинфекционной пандемией XXI века. Согласно эпидемиологическим данным частота встречаемости ожирения в мире с 1975 года утроилась. На сегодняшний день от осложнений, связанных с ожирением, погибает больше людей, чем от аномально низкой массы тела. По прогнозу Всемирной организации здравоохранения, при сохранении тенденции распространения заболевания, через десять лет 60% населения мира, то есть 3,3 миллиарда человек, будут иметь избыточный вес, а 1,1 миллиард страдать ожирением. В Российской Федерации на 2016 г. ожирение диагностировалось у 26,2%, избыточная масса тела у 62,0% населения [11].
Ожирение — хроническое заболевание обмена веществ, развивающееся в результате дисбаланса потребления и расхода энергии и проявляющееся избыточным развитием жировой ткани, прогрессирующее при естественном течении, имеющее определенный круг осложнений, повышающее риск развития различных заболеваний, с высокой вероятностью рецидива после окончания лечения. Морбидное ожирение диагностируется при индексе массы тела (ИМТ) ≥ 40 кг/м2, вне зависимости от осложнений или ИМТ ≥ 35 кг/м2 при наличии серьёзных осложнений, ассоциированных с ожирением [12].
Исходное состояние печения может играть ключевую роль в развитии новой коронавирусной инфекции и определять тяжесть ее течения.
Во время предыдущей эпидемии атипичной пневмонии у 60% пациентов наблюдались поражения печени различной степени тяжести. В условиях нынешней пандемии нарушение функции печени наблюдается у 14–53% пациентов с COVID-19, особенно у пациентов с тяжелым течением болезни [13].
Для всех трех типов коронавируса, печень может являться органом мешенью. Фермент дипептидилпептидаза-4 (DPP-4), являвшийся ключевым для проникновения в клетку MERS-CoV, в большом количестве присутствует в тканях печени. В литературе присутствует неоднозначная информация о репликации вируса коронавирусов в гепатоцитах. При изучении аутопсийного материала специалисты из Саудовской Аравии обнаружили гистологические изменения ткани печени у пациентов с подтвержденным MERS-СOV, но сами вирусные частицы обнаружены не были [14].
Высокая экспрессия рецепторов ACE2, ключевых рецепторов для проникновения в клетки SARS-CoV-2, отмечается на альвеолярных клетках легких 2 типа (более 80 %), в эндотелии сосудов малых и крупных артерий и вен, а так же в базальном слое плоского эпителия, слизистой оболочки носа, полости рта и носоглотки [13,15]. Так же экспрессия ACE2 высока в желудочно-кишечном тракте: в гладких мышцах слизистой оболочки желудка, энтероцитах двенадцатиперстной, тощей и подвздошной кишок [16].
Chai X. et al. выявили своеобразное распределение рецепторов к ангиотензин превращающему ферменту 2 в гепатобилиарной системе. Рецепторы в большей степени экспрессируются на эндотелии мелких кровеносных сосудов и минимально на синусоидальном эндотелии. Наиболее активная экспрессия рецептора отмечается на холангиоцитах (59,7%), что сопоставимо с уровнем экспрессии в альвеолярных клетках легких 2 типа, тогда как в гепатоцитах данный показатель равен 2,6% [17]. Иммуногистохимические окрашивания не выявило рецепторов к ACE2 на клетках Купфера, Т- и В-лимфоцитах. [15,17,18]. Jinyang G. et al. обнаружила в тканях печени вирусные нуклеиновые кислоты SARS, а в цитоплазме гепатоцитов типичные для коронавирусов шиповидные структуры [9]. Высокий уровень экспрессии рецептора ACE2 на холангиоцитах и обнаружение нуклеиновых кислот вируса непосредственно в гепатоцитах указывает на то, что печень является потенциальной мишенью для SARS-CoV-2, при этом проникновение вируса может осуществляться через холангиоциты внутрипеченочных желчных протоков.
С целью изучения потенциальной взаимосвязи ожирения, поражения печени и характера течения COVID-19 ретроспективно были проанализированы истории болезни пациентов, проходивших лечение коронавирусной пневмонии на базе клиники СЗГМУ им. И.И. Мечникова в мае-июне 2020 года.
МАТЕРИАЛЫ И МЕТОДЫ.
В исследовании приняли участие 73 пациента 37 (51,4%) женщин и 36 (48,6%) мужчин) с подтвержденной, при проведении компьютерной томографии (КТ), пневмонией, вызванной SARS-CoV-2.
Всем пациентам выполнялся стандартный набор физикальных, инструментальных и лабораторных исследований на момент поступления в стационар: физикальное обследование, включая антропометрию и пульсоксиметрию; КТ для определения процента поражения легочной ткани; электрокардиографию; лабораторное обследование – клинический, биохимический анализы крови, анализ мочи, коагулограмму; ПЦР на SARS-CoV-2.
Исследование имело ретроспективный дизайн. Статистическая обработка данных осуществлялась в программе STATISTICA10.
Результаты.
Антропометрические данные участников исследования представлены в таблице 1.
Табл.1 Антропометрические параметры пациентов с COVID-19.
| Показатель | Среднее значение | Минимальное зафиксированное значение | Максимальное зафиксированное значение | ||
| Возраст (лет) | 55,2±18,8 | 28 | 82 | ||
| Рост (м) | 1,68±0,099 | 1,33 | 1,85 | ||
| Вес (кг) | 87,2±16,2 | 50 | 130 | ||
| Окружность талии (см) | 103,5±13,5 | 65 | 132 | ||
| Индекс массы тела (ИМТ) | |||||
| ИМТ | Частота встречаемости | % | |||
| ИМТ=25-30 кг/м2 | 25 человек | 34,7% | |||
| ИМТ˃30 кг/м2 | 36 человек | 51,3% | |||
| Ожирение | |||||
| I степени | 22 человека | 30,5% | |||
| II степени | 8 человек | 11,1% | |||
| III степени | 7 человек | 9,7 | |||
Средний ИМТ у участников исследования равнялся 30,8±5,8 кг/м2 (от 21,7 кг/м2 до 48,06 кг/м2), окружность талии составляла 103,5±13,5см. Абдоминальным ожирением страдало 77% пациентов.
Наиболее частыми хроническими заболеваниями у пациентов являлись: гипертоническая болезнь – 65 (90%) пациентов, ишемическая болезнь сердца – 37 (51%) пациентов, СД 2 типа – 14 (19,4%) пациентов.
На момент поступления в стационар по данным КТ грудной клетки пациенты ранжировались следующим образом:
- КТ 1 (вовлечение ≤ 25% паренхимы легких) диагностировалось у 11 (15,2%) пациентов;
- КТ 2 (вовлечение 25–50% паренхимы легких) диагностировалось у 33 (45,8%) пациентов;
- КТ 3 (вовлечение 50–75% паренхимы легких) диагностировалось у 20 (27,7%) пациентов;
- КТ 4 (вовлечение паренхимы легкого ≥75%) диагностировалось у 6 (8,3%) пациентов.
Сатурация крови кислородом (SpO2) находилось на уровне от 85 до 98% и в среднем составляла 93±3,2%.
Данные стандартного лабораторного обследования участников исследования представлены в таблице 2.
Табл.2 Результаты лабораторных исследований у пациентов с COVID-19.
| Лабораторный показатель | Среднее значение | Минимальное значение | Максимальное значение | Единицы измерения |
| СРБ | 76,2±55,1 | 0,91 | 203 | мг/л |
| Глюкоза | 6,19 ±1,5 | 3,5 | 11,6 | ммоль/л |
| АЛТ | 76,2±58,8 | 15,0 | 311,0 | ед/л |
| АСТ | 60,7±48,6 | 6,0 | 276,0 | ед/л |
| Ферритин | 992,1±1078 | 25,2 | 4992,3 | нг/мл |
| Лейкоциты | 7,1±2,6 | 3 | 15 | x109/л |
| Нейтрофилы | 5,7±6,7 | 1,5 | 59,2 | x109/л |
| Лимфоциты | 1,61±1,5 | 0,4 | 13 | x109/л |
| Тромбоциты | 256 ±103,6 | 104 | 719 | x109/л |
| Гемоглобин | 135,5±25,4 | 67 | 191 | г/л |
| Д-димер | 1,24±2,08 | 0,06 | 11,04 | нг/мл |
Цитолитический синдром диагностировался у 54 (71%) пациентов на момент поступления.
При сравнении групп пациентов с цитолизом и без цитолиза при помощи критерия Манна-Уитни было выявлено, что больные с явлениями цитолиза моложе: средний возраст пациентов с цитолизом 56,3±13,2 лет, пациентов без цитолиза 64,2±17,2 лет (р=0,003), у пациентов с цитолизом отмечаются достоверно более высокие уровни СРБ (р=0,03). По другим показателям, включая антропометрические данные и распространенность инфильтрации в легких группы между собой не отличались.
Участники исследования, страдающие и не страдающие ожирением, не отличались по оцениваемым в исследовании лабораторным и инструментальным данным. Абдоминальное ожирение закономерно чаще выявлялось у мужчин, у пациентов с гипертонической болезнью, а также у пациентов с повышенным гематокритом.
При оценке коэффициента ранговой корреляции Спирмена аминотрансферазы имели отрицательную корреляцию связь с возрастом пациента ( коэффициент ранговой корреляции для АЛТ=-0,3; АСТ=-0,26 ) и наличием СД 2 типа (коэффициент ранговой корреляции для АЛТ=-0,28, АСТ=-0,25). Таким образом более выраженное повышение трансаминаз было характерно для пациентов младших возрастных групп и пациентов, не страдающих сахарным диабетом.
Положительная корреляция наблюдалась между уровнем ферритина и концентрацией АЛТ (0,34) и АСТ (0,36). Уровень АСТ имел отрицательную корреляционную связь с SPO2 (-0,37). Низкие значения SрО2 были ассоциированы с повышением плазменной концентрации АСТ. Концентрация АЛТ у мужчин была достоверно выше, чем у женщин, что может объясняться более частым присутствием абдоминального ожирения.
СРБ имел достоверную положительную корреляционную связь со степенью изменений в легких по данным КТ (0,37), уровнем лейкоцитов (0,32), уровнем нейтрофилов (0,49), д-димером (0,29) и глюкозой плазмы крови (0,27) и отрицательную корреляционную связь с SрО2 (-0,25) и концентрацией лимфоцитов (-0,28).
Степень ожирения отрицательно коррелировала с концентрацией лейкоцитов (-0,23) и нейтрофилов (-0,29).
Обсуждение полученных результатов.
Летальности от коронавирусной инфекции, составляющая 2-6%, выше у пациентов с ожирением и ассоциированными метаболическими заболеваниями, в частности НАЖБП [13].
При НАЖБП происходит жировая дистрофия гепатоцитов с накоплением в них капель жира, нередко развивается воспалительная инфильтрация, фокальный некроз печеночных клеток с последующим замещением их соединительной тканью. Жировая дистрофия тесно коррелирует с инсулинорезистентностью, сопровождается снижением способности инсулина подавлять продукцию глюкозы и липопротеинов очень низкой плотности гепатоцитами [19], что вызывает гипергликемию и гипертриглицеридемию. Прогрессирование болезни коррелирует с выраженностью метаболических отклонений, которые в свою очередь обуславливают развитие функциональных и структурных сосудистых нарушений – эндотелиальной дисфункции, увеличения толщины комплекса интима-медиа, кальцификации и атеросклеротических бляшек. В большинстве исследований показано, что биохимические маркеры атеросклероза, системного воспаления, гиперкоагуляции выше у пациентов с НАЖБП, независимо от ИМТ [20].
Основная гипотеза, послужившая причиной проведения данного ретроспективного анализа, заключалась в том, что ключевую роль в тяжелом течение COVID-19 у пациентов с ожирением играет печень, в частности наличие и выраженность НАЖБП. Кроме того, у пациентов с НАЖБП потенциально чаще развивается острое повреждение печени SARS-CoV-2, учитывая имеющуюся дефектность данного органа.
В исследовании китайских коллег, в котором сравнивались пациенты с COVID-19, имеющие и не имеющие ожирение, было продемонстрированно, что пациенты с ожирением имеют более высокие уровни аминотрансфераз, глюкозы, ЛПНП, более низкое количество лимфоцитов и тяжелее переносят заболевание [10]. У пациентов с ожирением и НАЖБП повышен синтез провоспалительных факторов в печени и висцеральном жире, в частности увеличены плазменные концентрации интерлейкина 6 (ИЛ-6), основного участника «цитокинового шторма». Таким образом, НАЖБП может предрасполагать к более тяжелому течению COVID-19 [10].
В процессе исследования аутопсийного материала пациентов, скончавшихся от коронавирусной пневмонии тяжелого течения, патоморфологами СЗГМУ им. И.И. Мечникова определялось выраженное жировое перерождение и полнокровие печени.
На рисунке 1 и 2 представлена гистологическая картина мускатной печени пациента 72 лет, скончавшегося от респираторного дистресс-синдрома и полиорганной недостаточности на фоне тотальной вирусной пневмонии (КТ 3-4 степени). Сопутствующими заболевания пациента являлись — абдоминальное ожирение, гипертоническая болезнь, ишемическая болезнь сердца, атеросклероз коронарных артерий, цереброваскулярная болезнь, церебральный атеросклероз. На представленных снимках ткань печени однородная, светло-коричневая, полнокровная, с сохраненной архитектоникой и очагами дискомплексации печеночных балок. Часть портальных трактов незначительно расширена за счет отека, местами со слабой лимфоплазмоцитарной инфильтрацией и фиброзом. В большей части гепатоцитов крупнокапельная и мелкокапельная жировая дистрофия и баллонная дистрофия. Отмечается неравномерное полнокровие синусов.
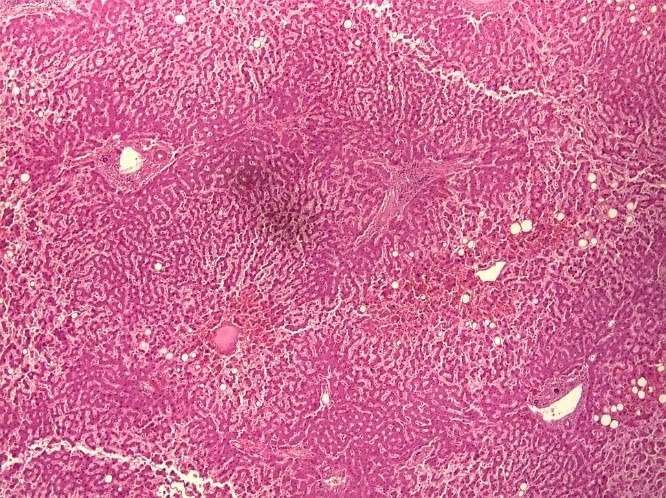
Рис.1. «Мускатная печень» пациента 70 лет, скончавшегося на фоне крайне тяжелого течения COVID-19 (увеличение х10).
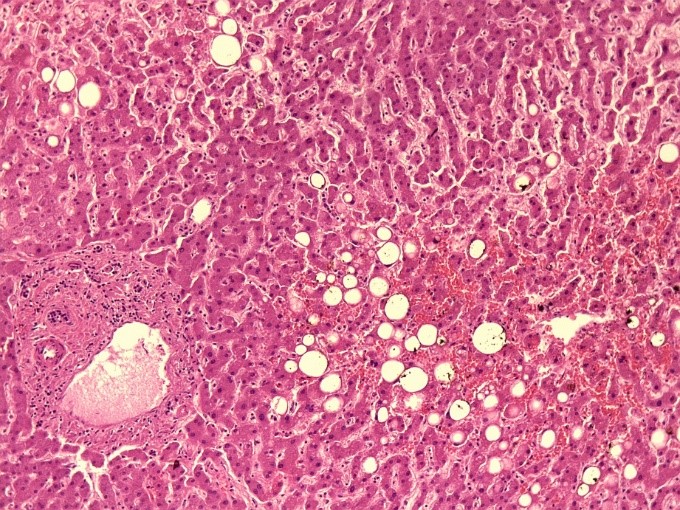
Рис.2 «Мускатная печень» пациента 70 лет, скончавшегося на фоне крайне тяжелого течения COVID-19 c заметным полнокровием синусов, крупно- и мелкокапельной жировой дистрофией (увеличение х20).
На рисунке 3 и 4 представлена гистологическая картина печени пациента 34 лет, скончавшегося от острой дыхательной недостаточности, на фоне тяжелой двусторонней полисегментарной пневмонии (КТ4), вызванной SARS-CoV-2. Основным фоновым заболеванием пациента являлось морбидное ожирение (ИМТ˃40 кг/м2).
При морфологическом исследовании ткань печени выглядит пестрой из-за чередования мелких очагов красного, темно-бордового и желтого цвета, вены печени не расширены, полнокровны, желчные протоки расширены. Отмечается резкое нарушение архитектоники за счет выраженной крупно- и мелкокапельной жировой дистрофии гепатоцитов в сочетании с холестазом. Центральные вены и капилляризированные синусоиды полнокровны, отмечается расширение пространств Диссе.
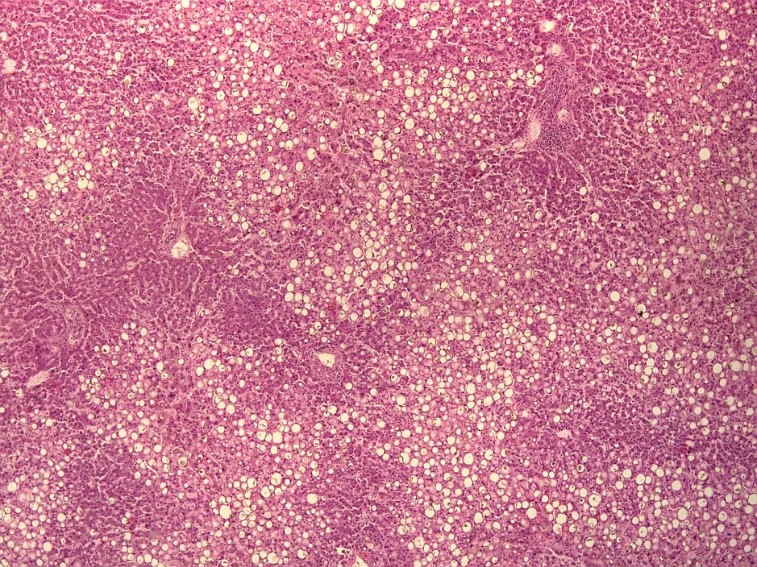
Рис.3. Стеатоз (мелко- и крупнокапельная жировая дистрофия гепатоцитов) на фоне венозного полнокровия ткани печени пациента 32 лет с морбидным ожирением, скончавшегося на фоне крайне тяжелого течения COVID-19. (увеличение х10).
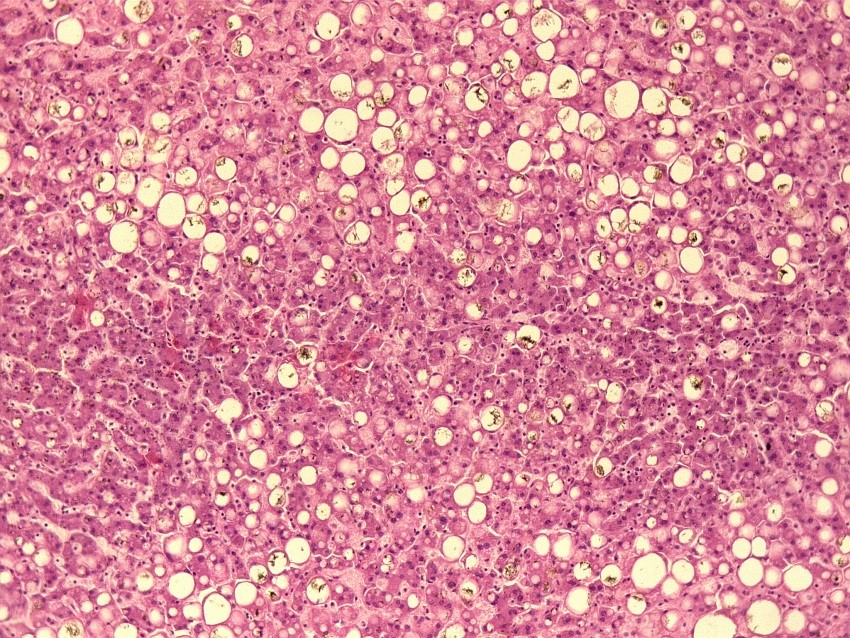
Рис.4 Жировая дистрофия печени с холестазом и кровоизлияния в синусоидальных капиллярах пациента 32 лет с морбидным ожирением, скончавшегося на фоне крайне тяжелого течения COVID-19 (увеличение х20).
По данным зарубежных патоморфологов при анализе аутопсийного материала пациентов с COVID-19, как правило, обнаруживалась увеличенная в размерах печень, с гладкой поверхностью, на разрезе глинистого вида. При гистологическом изучении выявлялись типичные для вирусного поражения печени признаки — увеличение количества митозов, апоптозные тельца, баллонизации гепатоцитов, увеличение числа двухъядерных гепатоцитов и жировая дистрофия. В инфицированных гепатоцитах определялся выраженный отек митохондрий, расширение цистерн эндоплазматического ретикулума, уменьшение количества гранул гликогена, при иммуногистохимическом исследовании небольшое количество CD4+- и CD8+-лимфоцитов [9,21]
В проведенном нами исследовании было выявлено, что пациенты с COVID-19 и цитолитическим синдромом, моложе и имеют более высокие уровни СРБ. При этом отличия по ИМТ и окружности талии от группы пациентов без цитолитического синдрома отсутствовали. Группы пациентов, страдающие и не страдающие ожирением, в частности его абдоминальной формой, не отличались между собой. Уровни АЛТ и АСТ имели отрицательную корреляционную связь с возрастом пациентов и наличием СД 2 типа. Таким образом повышение трансаминаз у участников исследования не было ассоциировано с ожирением, и чаще выявлялось у молодых пациентов без сахарного диабета. Данные факты явились неожиданными для нас, учитывая первоначальную гипотезу и результаты предшествующих исследований.
В исследовании была выявлена положительная корреляционная связь между уровнем трансаминаз и ферритином, острофазовым белком являющимся маркером тяжелого течения COVID-19, более высокие плазменные концентрации АЛТ и АСТ отмечались у пациентов с низкими значениями SPO2.
Таким образом, в исследовании нам не удалось установить связь между наличием ожирения и цитолитическим синдромом. Степень повышения трансаминаз зависела от тяжести течения COVID-19, маркерами которой является уровень ферритина, СРБ и сатурация крови кислородом.
Не исключается, что предполагаемую связь между ожирением и повреждением печени не удалось выявить по причине малого размера выборки и ее особенностей. Так в исследование были включены пациенты, госпитализированные в стационар по поводу пневмонии средней степени тяжести, вызванной SARS-CoV-2. Большинство из этих пациентов имело ожирение и ассоциированные с ожирением заболевания, а также повышение трансаминаз. Включение в анализ пациентов переносящих коронавирусную инфекцию легкого течения, а также пациентов с тяжелым и очень тяжелым течением возможно повлияло бы на конечные результаты исследования.
В научной международной литературе данные о влиянии сопуствующих патологий на развитием цитолитического синдрома у пациентов с COVID-19 неоднозначны [13,22]. Pan L. et al. из китайской провинции Хубэй не увидели четкой связи между тяжестью течения COVID-19 и повышением трансаминаз. Не смотря на то, что у пациентов из группы тяжелого течения COVID-19, уровни трансаминаз были выше, они не выходили за пределы референсных значений [22].
При этом большинство авторов все же указывает на более выраженное повышение трансаминаз у пациентов с более тяжелым течением COVID-19 [13,23]. Пациенты в субклинической стадии заболевании не имели цитолитического синдрома, в отличии от пациентов с выраженной клинической картиной, у которых диагноз ставился на более поздних стадиях [24].
Метаанализ 52 исследований, посвященных патологии гепатобилиарной системы при COVID-19, выявил четкую корреляцию между тяжестью течения инфекции и декомпенсацией функций печени. Распространенность цитолитического синдрома у пациентов с более тяжелым течением инфекции составила 38% (повышение АЛТ), 48% (повышение АСТ), против 30% (повышение АЛТ) и 21% (повышение АСТ) у пациентов с более легкой степенью тяжести. Различные гепатотоксические реакции определялись у каждого пятого пациента с COVID-19 [25].
Возможными причинами повреждения печени и развития цитолитического синдрома у пациентов с COVID-19 являются:
- Прямой повреждающий эффект вируса.
Учитывая более высокую экспрессию рецепторов ACE2 в холангиоцитах, печень является потенциальной мишенью для SARS-CoV-2.
- Повреждение печени используемыми лекарственными препаратами.
Повышение печеночных ферментов отмечается у пациентов, получавших терапию лопинавиром / ритонавиром [26]. Нестероидные противовоспалительные препараты и парацетамол нередко вызывают лекарственный гепатит. Стоит отметить, что при тяжелой бактериальной пневмонии, пациенты нередко принимают большее количество жаропонижающих средств, однако подобный цитолитический синдром не развивается.
- Гипоксическим повреждением печени вследствие дыхательной недостаточности.
- Повреждение печени в рамках микрососудистого тромбоза, возникающего вследствие повышения прокоагулянтной активности плазмы.
- Повреждение печени в рамках генерализованной воспалительной реакции с повышением СРБ, провоспалительных цитокинов, «цитокинового шторма».
- Лабораторная манифестация хронического заболевания печени (НАЖБП) на фоне воздействия вышеописанных факторов.
Механизмы развития цитолитического синдрома при новой короновирусной инфекции, а также исходы данного процесса остаются не до конца понятными, что требует дальнейшего исследования данной проблемы.
Подписаться и купить журнал можно
https://medalfavit.ru/product/prakticheskaja-gastrojenterologija/

